Introduzione
Indice dei contenuti
- Introduzione
- Definizione di cella elettrolitica
- Concetto di elettrolisi
- Ruolo della fonte di alimentazione a corrente continua nelle celle elettrolitiche
- Definizione di elettrolita
- Ruolo di anodo e catodo nelle celle elettrolitiche
- Movimento degli ioni nelle celle elettrolitiche
- Applicazione dell'elettrolisi nella produzione di rame
- Processo di purificazione del rame tramite elettrolisi
- Risultati finali del processo di purificazione del rame
- Conclusione
Le celle elettrolitiche svolgono un ruolo cruciale in diversi processi industriali, tra cui la purificazione del rame e la galvanotecnica. Queste celle utilizzano una fonte di energia esterna per attivare reazioni chimiche che portano alla decomposizione di sostanze. Attraverso il processo di elettrolisi, una corrente elettrica viene fatta passare attraverso un liquido o una soluzione contenente ioni, provocandone la decomposizione. In questo post esploreremo il concetto di celle elettrolitiche, il movimento degli ioni al loro interno e la loro applicazione nella produzione di rame. Immergiamoci quindi nell'affascinante mondo delle celle elettrolitiche!
Definizione di cella elettrolitica
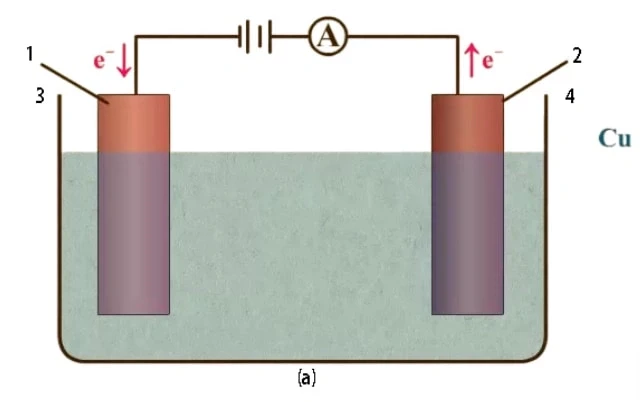
Una cella elettrolitica è una cella elettrochimica che utilizza una fonte di energia esterna per pilotare una reazione redox non spontanea. È comunemente utilizzata in processi come l'elettrolisi, in cui i composti chimici vengono decomposti. La cella elettrolitica è costituita da due elettrodi, un anodo (elettrodo con carica positiva) e un catodo (elettrodo con carica negativa), immersi in una soluzione elettrolitica. La fonte esterna di energia elettrica, come una batteria, viene applicata tra gli elettrodi per forzare la reazione chimica. Ciò è diverso da una cella galvanica, che è essa stessa una fonte di energia elettrica.
L'elettrolisi e le sue applicazioni
L'elettrolisi è una tecnica che utilizza una cella elettrolitica e una corrente elettrica continua per provocare reazioni chimiche che non avverrebbero spontaneamente. Un'importante applicazione dell'elettrolisi è la decomposizione dell'acqua in idrogeno e ossigeno. Questo processo viene utilizzato per la produzione di idrogeno gassoso, che può essere utilizzato come fonte di energia pulita e rinnovabile. Un'altra applicazione significativa è l'elettrolisi della bauxite per ottenere alluminio e altri prodotti chimici.
L'elettrolisi è un'altra applicazione comune dell'elettrolisi. Si tratta della deposizione di uno strato di metallo su una superficie mediante una cella elettrolitica. Rame, argento, nichel e cromo sono alcuni dei metalli che possono essere galvanizzati su vari oggetti.
Celle elettrochimiche e reazioni redox
Una cella elettrochimica è un dispositivo che genera elettricità da una reazione spontanea di ossidoriduzione o utilizza l'elettricità per pilotare una reazione non spontanea. Queste celle funzionano in base ai principi dell'elettrochimica, che studia la relazione tra elettricità e reazioni chimiche.
In una reazione redox, gli elettroni vengono trasferiti da una specie all'altra. Se la reazione è spontanea, rilascia energia che può essere sfruttata per compiere un lavoro utile. Al contrario, una reazione non spontanea richiede un apporto di energia per avvenire. Le celle elettrochimiche facilitano queste reazioni generando energia elettrica dalle reazioni chimiche o utilizzando l'energia elettrica per pilotare le reazioni.
Componenti delle celle elettrolitiche
I componenti principali di una cella elettrolitica sono il catodo, l'anodo e l'elettrolita. Il catodo è l'elettrodo con carica negativa, mentre l'anodo è l'elettrodo con carica positiva. L'elettrolita funge da mezzo per lo scambio di elettroni tra il catodo e l'anodo.
Gli elettroliti comunemente utilizzati nelle celle elettrolitiche sono l'acqua contenente ioni disciolti e il cloruro di sodio fuso. Il flusso di elettroni nella cella elettrolitica supera la barriera dell'energia di attivazione della reazione redox non spontanea, consentendo la trasformazione chimica desiderata.
Conclusione
In sintesi, una cella elettrolitica è un dispositivo elettrochimico che utilizza l'energia elettrica per pilotare una reazione redox non spontanea. È comunemente utilizzata in processi come l'elettrolisi e la galvanotecnica. La comprensione dei principi dell'elettrochimica e dei componenti delle celle elettrolitiche è essenziale per utilizzare queste celle per varie applicazioni.
Concetto di elettrolisi
L'elettrolisi è il processo di passaggio di una corrente elettrica attraverso un liquido o una soluzione contenente ioni, che porta alla decomposizione delle sostanze.
Prodotto dell'elettrolisi
L'elettrolisi prevede l'uso dell'elettricità per scomporre o decomporre un composto, di solito un composto ionico allo stato fuso o in soluzione acquosa. I prodotti dell'elettrolisi possono essere atomi, molecole, ioni o gas. Il tipo di elettrodo e di elettrolita utilizzato determina il prodotto specifico del processo di elettrolisi.
Nell'elettrolisi, gli elettrodi svolgono un ruolo cruciale nel condurre l'elettricità verso o dalla cellula attraverso il movimento degli elettroni. Esistono due tipi di elettrodi:
-
Anodo: L'elettrodo positivo è chiamato anodo. Gli ioni con carica negativa si muovono verso l'anodo, dove avviene l'ossidazione.
-
Catodo: l'elettrodo negativo è chiamato catodo. Gli ioni con carica positiva si muovono verso il catodo, dove avviene la riduzione.
Gli elettrodi nell'elettrolisi
Durante l'elettrolisi, una corrente elettrica viene fatta passare dentro e fuori una soluzione elettrolitica per ripristinare il flusso di ioni necessario per una reazione non spontanea. Il processo prevede l'immersione e la separazione di elettrodi a distanza. La corrente elettrica, fornita da una fonte di alimentazione, viaggia attraverso l'elettrolita, completando il circuito elettrico.
Per pilotare la reazione di elettrolisi si utilizza una corrente continua (DC). Questa corrente fa sì che gli ioni presenti nell'elettrolita vengano attratti verso gli elettrodi di carica opposta, il catodo e l'anodo. La quantità di energia elettrica richiesta è pari alla variazione dell'energia libera di Gibbs della reazione, oltre alle eventuali perdite nel sistema.
Processo di elettrolisi
Il processo di elettrolisi prevede l'uso di una cella elettrolitica, costituita da elettrodi positivi e negativi tenuti separati e immersi in una soluzione contenente ioni con carica positiva e negativa. La sostanza da trasformare può formare l'elettrodo, costituire la soluzione o essere disciolta nella soluzione.
L'elettrodo con carica negativa, noto come catodo, funge da punto di ingresso per la corrente elettrica. I componenti della soluzione migrano verso il catodo, si combinano con gli elettroni e subiscono una riduzione, con conseguente formazione di elementi neutri o nuove molecole.
Al contrario, anche i componenti della soluzione si muovono verso l'elettrodo a carica positiva, chiamato anodo. All'anodo, questi componenti rilasciano i loro elettroni e subiscono l'ossidazione, portando alla formazione di elementi neutri o di nuove molecole.
Se la sostanza da trasformare è l'elettrodo stesso, la reazione spesso comporta la dissoluzione dell'elettrodo che cede gli elettroni.
L'elettrolisi è un processo fondamentale della chimica che permette la decomposizione e la trasformazione delle sostanze attraverso l'applicazione di corrente elettrica. Ha svolto un ruolo significativo nella scoperta e nella comprensione di vari elementi della chimica moderna.
Ruolo della fonte di alimentazione a corrente continua nelle celle elettrolitiche
Celle elettrolitiche
Per comprendere il ruolo di una fonte di alimentazione a corrente continua nelle celle elettrolitiche, è necessario innanzitutto comprendere il concetto di elettrolisi. L'elettrolisi è un processo in cui una corrente elettrica viene fatta passare attraverso un liquido contenente ioni, provocando la rottura dei composti all'interno del liquido. Questo metodo è comunemente usato per separare i metalli dai composti metallici, isolare altre sostanze chimiche, elettroplaccare i metalli e ricaricare le batterie.
Affinché l'elettrolisi si verifichi, è necessario un circuito completo per prelevare continuamente elettricità dalla cella. Una cella elettrolitica è costituita da due elettrodi stabili, il catodo e l'anodo, collegati a una fonte di alimentazione. Questi elettrodi, insieme a una soluzione elettrolitica fluida, sono componenti essenziali di ogni cella elettrolitica. La soluzione elettrolitica conduce l'elettricità perché gli ioni disciolti possono muoversi liberamente all'interno della soluzione.

Definizione: Elettrolisi
L'elettrolisi è un processo in cui una corrente elettrica viene fatta passare attraverso un liquido o una soluzione contenente ioni, provocando la decomposizione delle sostanze contenute.
Per sostenere una reazione elettrolitica, è necessario un circuito completo che riceva continuamente energia da una batteria o da un alimentatore. Ciò richiede la capacità degli ioni di muoversi liberamente all'interno dell'elettrolita.
Nelle celle elettrolitiche si utilizza una fonte di alimentazione a corrente continua, il che significa che gli elettrodi sono sempre positivi o negativi. Questa polarità è fondamentale affinché il processo elettrolitico avvenga in modo efficace.
Per elettrolita si intende una sostanza o una miscela che conduce l'elettricità e può subire l'elettrolisi.
Quando una corrente continua viene fatta passare attraverso l'elettrolita in una cella elettrolitica, avviene l'elettrolisi. Nel caso della purificazione del rame, l'anodo di rame impuro viene ossidato e forma ioni Cu2+. All'elettrodo catodico, gli ioni di rame positivi subiscono una riduzione, con conseguente produzione di rame metallico puro. Le impurità sotto forma di altri metalli non si dissolvono, ma formano un fango solido sul fondo del contenitore.
Tipi di celle elettrochimiche
Le celle elettrochimiche possono essere classificate in tre tipi: celle ricaricabili, celle non ricaricabili e celle a combustibile.
Le celle a combustibile richiedono una fornitura esterna di combustibile, che serve come fonte di energia chimica necessaria per generare elettricità. Le batterie ricaricabili e non ricaricabili, invece, hanno il carburante immagazzinato internamente alla batteria stessa.
La comprensione del ruolo di una fonte di alimentazione a corrente continua nelle celle elettrolitiche è fondamentale per sfruttare l'energia dell'elettrolisi in vari processi industriali, come la purificazione dei metalli e la galvanizzazione. Utilizzando una sorgente di corrente continua, le celle elettrolitiche consentono la decomposizione delle sostanze e la creazione di sostanze elementari pure o di altri prodotti chimici.
Definizione di elettrolita
Un elettrolita è un tipo di sostanza o miscela che contiene ioni mobili che possono subire l'elettrolisi. Ciò significa che quando una corrente elettrica passa attraverso un elettrolita, la sostanza al suo interno subisce un cambiamento chimico. Gli elettroliti possono esistere sotto forma di soluzione salina o di sale fuso.

Anodo e catodo
Nel contesto dell'elettrolisi, i termini anodo e catodo si riferiscono agli elettrodi coinvolti nel processo. L'anodo è l'elettrodo dal quale fluiscono gli elettroni, mentre il catodo è l'elettrodo verso il quale fluiscono gli elettroni. In una cella elettrolitica, l'anodo è l'elettrodo positivo.
Conducibilità degli elettroliti
Gli elettroliti sono in grado di condurre l'elettricità perché contengono ioni liberi di muoversi. Quando viene applicata una corrente elettrica, gli anioni dell'elettrolita si muovono verso l'anodo e vengono ossidati, mentre i cationi si muovono verso il catodo e vengono ridotti. Questo movimento di ioni consente il flusso di carica elettrica attraverso l'elettrolita.
Tipi di elettroliti
Esistono due tipi principali di elettroliti: gli elettroliti forti e gli elettroliti deboli. Gli elettroliti forti si dissociano completamente in ioni quando vengono disciolti in una soluzione, mentre gli elettroliti deboli si dissociano solo parzialmente in ioni.
Esempi di elettroliti forti sono i sali solubili, gli acidi e le basi. Queste sostanze consentono il passaggio della corrente elettrica tra l'anodo e il catodo in una batteria o in una cella elettrolitica. Gli elettroliti deboli, invece, non si dissociano completamente in ioni in una soluzione.

Cella elettrochimica
Una cella elettrochimica è un dispositivo che converte l'energia elettrica in energia chimica e viceversa. È costituita da una soluzione elettrolitica, da un ponte di sale e da elettrodi. L'elettrolita in una batteria è la sostanza che permette il flusso di corrente elettrica tra l'anodo e il catodo. Gli elettroliti possono essere sotto forma di fluidi o di solidi.
In una cella elettrochimica, la corrente scorre attraverso l'elettrolita sotto forma di ioni piuttosto che di elettroni. Gli ioni con carica negativa, chiamati anioni, passano dal catodo all'anodo, mentre gli ioni con carica positiva, chiamati cationi, passano dall'anodo al catodo. Questo flusso bidirezionale di ioni consente il trasferimento di carica elettrica attraverso l'elettrolita.
L'elettrolisi
L'elettrolisi è un processo in cui una corrente elettrica viene fatta passare attraverso una sostanza per indurre un cambiamento chimico. Viene comunemente eseguita in una cella elettrolitica, che consiste in elettrodi positivi e negativi immersi in una soluzione contenente ioni con carica positiva e negativa.
Durante l'elettrolisi, gli elettroni entrano attraverso il catodo, facendo sì che i componenti della soluzione si combinino con gli elettroni e subiscano una riduzione. Allo stesso tempo, i componenti della soluzione si spostano verso l'anodo, cedono i loro elettroni e subiscono un'ossidazione. I prodotti di queste reazioni possono essere elementi neutri o nuove molecole.
In alcuni casi, la sostanza da trasformare può formare l'elettrodo, costituire la soluzione o essere disciolta nella soluzione. Indipendentemente dalla configurazione specifica, l'elettrolisi consente di manipolare in modo controllato le reazioni chimiche attraverso l'applicazione di una corrente elettrica.
Ruolo dell'anodo e del catodo nelle celle elettrolitiche

Anodo: Elettrodo che fornisce elettroni al circuito esterno.
L'anodo di una cella elettrolitica svolge un ruolo cruciale nel processo elettrochimico. È l'elettrodo in cui avviene l'ossidazione, il che significa che gli elettroni escono dall'anodo verso il circuito esterno. Questo flusso di elettroni consente il trasferimento di carica e il completamento del circuito elettrico all'interno della cella.
Nelle celle elettrolitiche, l'anodo è carico positivamente. Serve come fonte di elettroni necessari per le reazioni di riduzione che avvengono al catodo. L'anodo è tipicamente costituito da un materiale reattivo, come il rame, l'argento o l'oro, che può dissociarsi nell'elettrolita e facilitare il flusso di ioni.
Catodo: elettrodo che accetta gli elettroni dal circuito esterno.
Il catodo è invece l'elettrodo che accetta gli elettroni dal circuito esterno in una cella elettrolitica. È l'elettrodo negativo dove avvengono le reazioni di riduzione. Gli elettroni che arrivano al catodo dal circuito esterno si combinano con l'agente ossidante presente nella cella, portando alla riduzione dell'agente ossidante.
Il catodo è essenziale per il funzionamento complessivo della cella elettrolitica. Serve come luogo in cui avvengono le reazioni chimiche desiderate, che danno origine ai prodotti desiderati. Nel caso dell'elettrolisi, il catodo è caricato negativamente per attirare verso di sé i cationi caricati positivamente. Una volta che i cationi raggiungono il catodo, possono essere ridotti guadagnando elettroni, portando alla formazione dei prodotti desiderati.
Sia l'anodo che il catodo sono componenti cruciali delle celle elettrolitiche e si trovano in vari dispositivi elettrici come batterie, celle a combustibile, celle fotovoltaiche, celle elettrolitiche e diodi. L'elettrolita, che funge da condotto per il flusso di elettroni tra il catodo e l'anodo, svolge un ruolo importante nel facilitare le reazioni elettrochimiche.
La comprensione del ruolo dell'anodo e del catodo nelle celle elettrolitiche è essenziale per comprendere i principi di funzionamento di questi dispositivi. L'anodo facilita le reazioni di ossidazione, mentre il catodo consente le reazioni di riduzione, portando alle trasformazioni chimiche desiderate. Sfruttando la potenza dell'elettrolisi, è possibile ottenere in modo efficiente ed efficace diverse applicazioni, come la produzione di rame puro.
Movimento degli ioni nelle celle elettrolitiche
Cationi: Viaggiano verso il catodo e vengono ridotti
Il catodo è l'elettrodo positivo di una cella elettrolitica. È il luogo in cui avviene la reazione di riduzione. I cationi, che sono ioni con carica positiva, viaggiano verso il catodo e vengono ridotti. Ciò significa che guadagnano elettroni al catodo. Questa reazione di riduzione è essenziale in vari processi industriali, come la produzione di rame ad alta purezza e di altri metalli come sodio, magnesio e alluminio. In questi processi, i cationi vengono elettrolizzati per produrre il metallo desiderato.
Anioni: Vanno verso l'anodo e vengono ossidati.
L'anodo è l'elettrodo negativo di una cella elettrolitica. È il luogo in cui avviene la reazione di ossidazione. Gli anioni, che sono ioni con carica negativa, si dirigono verso l'anodo e vengono ossidati. Ciò significa che perdono elettroni all'anodo. L'ossidazione degli anioni può portare alla liberazione di gas come l'ossigeno o alla deposizione di alcuni elementi. Ad esempio, nell'elettrolisi dei sali di rame e d'argento, i cationi si riducono al catodo, mentre nell'elettrolisi dei sali di potassio, sodio e calcio si libera idrogeno gassoso a causa della riduzione dell'acqua.

In sintesi, nelle celle elettrolitiche i cationi si dirigono verso il catodo e vengono ridotti, mentre gli anioni si dirigono verso l'anodo e vengono ossidati. Questo movimento di ioni è fondamentale per i vari processi elettrochimici che si verificano nelle celle elettrolitiche.
Catodo
Il catodo, l'elettrodo positivo di una cella elettrolitica, svolge un ruolo cruciale nella reazione di riduzione che ha luogo. È il luogo in cui gli elettroni fluiscono dal circuito elettrico alla parte non metallica della cella. Al catodo, i cationi si riducono assorbendo gli elettroni provenienti dal filo collegato al catodo. Questa reazione di riduzione è importante in processi come la produzione di rame ad alta purezza e di altri metalli.
L'elettrolisi
L'elettrolisi è il processo che avviene in una cella elettrolitica, dove l'energia elettrica viene utilizzata per eseguire reazioni chimiche non spontanee. Nell'elettrolisi, l'ossidazione avviene all'anodo, che è la piastra positiva, mentre la riduzione avviene al catodo, che è la piastra negativa. La cella elettrolitica converte l'energia elettrica in energia chimica attraverso queste reazioni redox.
Conduzione in una cella elettrolitica
In una cella elettrolitica, la corrente passa attraverso il circuito esterno grazie al movimento degli elettroni, ma all'interno della cella stessa avviene un processo diverso. Gli ioni positivi dell'elettrolita guadagnano elettroni al catodo e subiscono una riduzione, mentre gli ioni negativi migrano verso l'elettrodo positivo (anodo) dove rilasciano elettroni e subiscono un'ossidazione. Questo movimento di ioni ed elettroni all'interno della cella è il modo in cui avviene il processo di elettrolisi.
Tipi di elettroliti
Gli elettroliti possono essere classificati come forti o deboli, a seconda della misura in cui si ionizzano in una soluzione acquosa. Gli elettroliti forti ionizzano in larga misura e conducono una forte corrente elettrica, mentre gli elettroliti deboli ionizzano in misura ridotta e conducono una piccola quantità di corrente elettrica.
Anodo
L'anodo è l'elettrodo attraverso il quale la corrente convenzionale entra in una cella elettrochimica. È il luogo in cui avvengono le reazioni di ossidazione. Gli ioni negativi o gli anioni sono inclini a reagire e a cedere elettroni all'anodo a causa del loro potenziale elettrico. Gli elettroni si muovono poi nel circuito. In una cella galvanica, l'anodo è negativo e gli elettroni si muovono in gran parte verso la parte esterna del circuito.
Esempi di elettrodi
Esistono due tipi di elettrodi: elettrodi reattivi ed elettrodi inerti. Gli elettrodi reattivi partecipano alla reazione che avviene nella cella e possono dissociarsi nell'elettrolita. Esempi di elettrodi reattivi sono il rame, l'argento e l'oro.
In conclusione, la comprensione del movimento degli ioni nelle celle elettrolitiche è fondamentale per comprendere i processi elettrochimici che si verificano in queste celle. I cationi vanno verso il catodo e vengono ridotti, mentre gli anioni vanno verso l'anodo e vengono ossidati. Questo movimento di ioni e il flusso di elettroni che lo accompagna sono alla base dell'elettrolisi, in cui l'energia elettrica viene utilizzata per attivare reazioni chimiche non spontanee.
Applicazione dell'elettrolisi nella produzione di rame
Estrazione di metalli
L'elettrolisi è ampiamente utilizzata nell'estrazione dei metalli. Esistono due metodi di estrazione dei metalli mediante elettrolisi:

-
Estrazione dello zinco: In questo processo, il minerale di zinco viene trattato con acido solforico per ottenere una soluzione di solfato di zinco. La soluzione viene quindi elettrolizzata in un serbatoio, con catodi di alluminio e anodi di piombo. La densità di corrente viene mantenuta a 1000 A/m2 e lo zinco si deposita sul catodo. Il consumo energetico per questo processo è di circa 3000-5000 KWH per tonnellata.
-
Estrazione dell'alluminio: I minerali di alluminio, come la bauxite e la criolite, vengono trattati chimicamente e ridotti a ossido di alluminio. L'ossido di alluminio viene poi sciolto in criolite fusa ed elettrolizzato in un forno. L'alluminio si deposita al catodo e si deposita sul fondo. La temperatura della fornace viene mantenuta a circa 1000°C ed è necessaria una corrente di circa 4000 ampere. L'energia consumata per questo processo è di circa 20.000-25.000 KWH per tonnellata.
Raffinazione dei metalli
L'elettrolisi viene utilizzata anche per la raffinazione dei metalli. I principali vantaggi dell'utilizzo dei processi elettrolitici per la raffinazione dei metalli sono l'elevata purezza del prodotto ottenuto (circa 98-99%) e la possibilità di raffinare ulteriormente il metallo. Nel processo di raffinazione, l'anodo è costituito dal metallo estratto e il metallo puro viene depositato al catodo. L'elettrolita utilizzato è costituito dalla soluzione del metallo, come il solfato di rame per la raffinazione del rame e il cloruro di nichel per la raffinazione del nichel. Il consumo energetico per la raffinazione del rame mediante processo elettrolitico è di circa 150-300 KWH per tonnellata di rame raffinato.
Nel complesso, l'elettrolisi svolge un ruolo cruciale nell'estrazione e nella raffinazione dei metalli, garantendo un'elevata purezza e qualità del prodotto finale.
Processo di purificazione del rame tramite elettrolisi
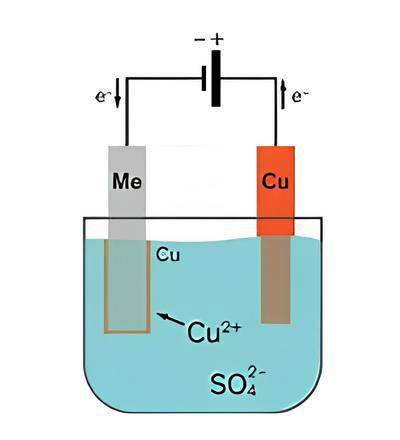
Piastre di rame impuro vengono poste in un bagno di soluzione di solfato di rame(II)
Nel processo di purificazione del rame tramite elettrolisi, le lastre di rame impure vengono prima prodotte dall'estrazione del minerale di rame. Tuttavia, queste lastre di rame impure non sono sufficientemente pure per essere utilizzate in elettronica e in altre applicazioni critiche. Per ottenere lastre di rame più pure, si ricorre all'elettrolisi.
Le lastre di rame impure vengono poste in un bagno di soluzione di solfato di rame (II). Questa soluzione funge da elettrolita nel processo di elettrolisi. Le piastre di rame impure sono collegate al terminale positivo di un alimentatore esterno, mentre una piastra di rame puro è collegata al terminale negativo dell'alimentatore.
L'alimentazione esterna attiva le reazioni che portano alla placcatura del catodo con il rame
L'alimentazione esterna provoca due reazioni nel processo di elettrolisi. All'anodo (la piastra di rame impura), il rame viene ossidato e dissolto nell'elettrolita sotto forma di ioni Cu2+:
Cu(s) ⇒ Cu2+(aq) + 2e-
Questa reazione di ossidazione fa sì che l'anodo di rame impuro perda massa poiché il rame si dissolve nell'elettrolita.
Al catodo (la lastra di rame puro), gli ioni di rame nell'elettrolita si riducono guadagnando elettroni per formare il rame metallico:
Cu2+ (aq) + 2e- ⇒ Cu(s)
Questa reazione di riduzione provoca la placcatura del rame metallico sul catodo, con conseguente aumento della massa del catodo.
Le impurità presenti nelle piastre di rame impure vengono lasciate nell'elettrolita. Le impurità solubili rimangono nell'elettrolita, mentre quelle insolubili rimangono nell'anodo o cadono sul fondo del recipiente di reazione.
Il processo di elettrolisi è ampiamente utilizzato per la produzione di rame puro. Il rame è un metallo altamente conduttivo utilizzato in varie applicazioni come circuiti, fili, tubi e unità di raffreddamento. È noto anche per la sua malleabilità e duttilità.
L'elettrolisi svolge un ruolo cruciale nella fase finale di purificazione della produzione del rame. Utilizzando una cella elettrolitica con una soluzione di solfato di rame (II) come elettrolita, le lastre di rame impure possono essere trasformate in lastre di rame di elevata purezza. Questo processo garantisce che le lastre di rame soddisfino gli standard di purezza richiesti per le applicazioni cui sono destinate.
Nel complesso, l'elettrolisi è un metodo importante in metallurgia, che consente di convertire il rame impuro in rame di elevata purezza. Viene utilizzata anche per l'estrazione e la raffinazione di altri metalli come il sodio, il magnesio e l'alluminio. L'elettrolisi è un processo versatile che consente la produzione di metalli puri su larga scala.
Risultati finali del processo di purificazione del rame
L'anodo di rame impuro perde massa

Durante il processo di purificazione del rame, l'anodo di rame impuro subisce un'ossidazione e perde massa. Gli atomi di rame dell'anodo si dissolvono nella soluzione elettrolitica come ioni Cu2+.
Il catodo di rame puro acquista massa
Allo stesso tempo, il rame puro viene placcato sul catodo. Gli ioni di rame della soluzione elettrolitica vengono ridotti al catodo, con conseguente deposito di rame metallico puro. Di conseguenza, il catodo di rame puro acquista massa durante il processo di purificazione.
Le impurità solubili rimangono nell'elettrolita
Durante il processo di purificazione, le impurità solubili presenti nell'anodo di rame impuro non si depositano sul catodo. Rimangono invece nella soluzione elettrolitica. Ciò consente di separare le impurità dal rame purificato.
Le impurità insolubili rimangono nell'anodo o cadono sul fondo del recipiente di reazione.
Le impurità insolubili, come altri metalli o particelle solide, rimangono incorporate nell'anodo di rame impuro o cadono sul fondo del recipiente di reazione. Queste impurità non si dissolvono nella soluzione elettrolitica e vengono separate fisicamente dal rame purificato.
Il processo di purificazione prevede l'uso dell'elettrolisi, in cui l'energia elettrica viene utilizzata per guidare le reazioni chimiche. L'anodo di rame impuro funge da fonte di ioni di rame, mentre il catodo di rame puro funge da sito di deposizione del rame. Grazie a un attento controllo del processo, le impurità vengono lasciate indietro, ottenendo un rame di elevata purezza.
È importante notare che l'elettrolita utilizzato nel processo di purificazione, come il solfato di rame, svolge un ruolo cruciale nel facilitare il movimento degli ioni e nel consentire la separazione delle impurità. Inoltre, la temperatura e la corrente utilizzate durante l'elettrolisi influiscono sull'efficienza del processo di purificazione.
Nel complesso, i risultati finali del processo di purificazione del rame includono la perdita di massa dall'anodo di rame impuro, il guadagno di massa da parte del catodo di rame puro, la ritenzione delle impurità solubili nell'elettrolita e la separazione delle impurità insolubili nell'anodo o sul fondo del recipiente di reazione. Questi risultati portano alla produzione di rame di elevata purezza, rendendo la purificazione elettrolitica un metodo essenziale nell'industria metallurgica.
Conclusioni
In conclusione,le celle elettrolitiche svolgono un ruolo cruciale nella purificazione del rame e nella galvanotecnica. Utilizzando una fonte di energia esterna per pilotare le reazioni, l'elettrolisi consente la decomposizione di sostanze in un liquido o in una soluzione contenente ioni. L'anodo fornisce elettroni al circuito esterno, mentre il catodo accetta gli elettroni. I cationi vanno verso il catodo e vengono ridotti, mentre gli anioni vanno verso l'anodo e vengono ossidati. Nel processo di purificazione del rame, le lastre di rame impuro vengono immerse in una soluzione di solfato di rame e il catodo viene placcato con rame puro. Il risultato è una riduzione delle impurità nell'anodo e la produzione di rame di alta qualità.
Prodotti correlati
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Bagno d'acqua per cella elettrochimica elettrolitica multifunzionale a strato singolo e doppio
- Cella Elettrolitica Elettrochimica Ottica a Finestra Laterale
- Cella Elettrochimica Elettrolitica a Bagno d'Acqua Ottico
- Cella Elettrochimica per Corrosione Piatta
Articoli correlati
- Applicazioni delle celle elettrolitiche nella purificazione e nella galvanotecnica
- Elettrochimica La scienza delle celle elettrochimiche
- Capire gli elettrodi e le celle elettrochimiche
- L'arte della resistenza: perché la tua cella elettrolitica ha bisogno di spazio per respirare
- La Variabile Invisibile: Padroneggiare l'Ispezione della Cella Elettrolitica