In sostanza, l'elettrolisi è il processo di utilizzo dell'energia elettrica per guidare una reazione chimica che non avverrebbe da sola. Una fonte di alimentazione esterna applica una tensione attraverso due elettrodi immersi in una soluzione conduttiva o in un sale fuso, chiamato elettrolita. Questa energia applicata forza gli ioni a migrare verso elettrodi con carica opposta, dove subiscono la decomposizione attraverso reazioni di ossidazione e riduzione.
Una cella elettrolitica è un motore per invertire le reazioni chimiche. Applicando alimentazione esterna, forza gli elettroni a fluire contro la loro tendenza naturale, costringendo i composti chimici stabili a scomporsi nei loro elementi costituenti.

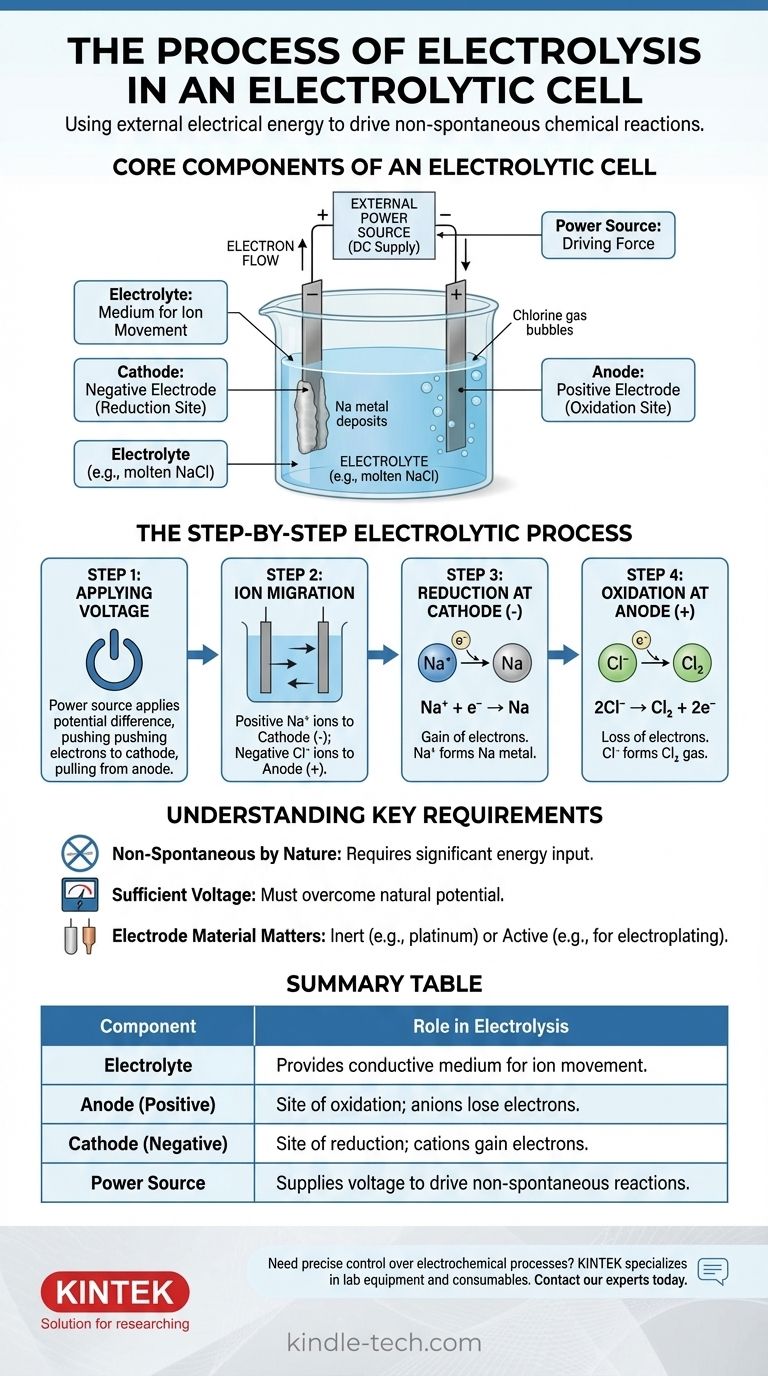
I componenti fondamentali di una cella elettrolitica
Per comprendere il processo, è necessario prima comprendere la funzione di ciascuna parte. Il sistema è un'interazione attentamente orchestrata tra tre componenti chiave.
L'elettrolita: un mezzo per il movimento degli ioni
L'elettrolita è una sostanza contenente ioni in movimento libero, il che la rende elettricamente conduttiva. È tipicamente un composto ionico fuso, come il cloruro di sodio (NaCl), o una soluzione acquosa contenente ioni disciolti.
L'unico scopo dell'elettrolita è fornire un mezzo attraverso il quale gli ioni carichi possano viaggiare tra gli elettrodi.
Gli elettrodi: anodo e catodo
Gli elettrodi sono materiali conduttivi (spesso metalli o grafite) immersi nell'elettrolita. Fungono da interfaccia fisica in cui il circuito elettrico incontra la soluzione chimica.
In una cella elettrolitica, la polarità è definita dalla fonte di alimentazione esterna:
- L'Anodo è l'elettrodo positivo.
- Il Catodo è l'elettrodo negativo.
La fonte di alimentazione esterna: la forza motrice
Questa è tipicamente una batteria o un alimentatore CC. Il suo compito è creare una differenza di potenziale attraverso gli elettrodi, forzando gli elettroni a muoversi in una direzione che non prenderebbero spontaneamente.
Questa tensione esterna è la "pompa" che guida l'intera reazione non spontanea, superando la naturale stabilità chimica dell'elettrolita.
Il processo elettrolitico passo dopo passo
Il processo si svolge in una sequenza precisa una volta che la fonte di alimentazione è attivata. Possiamo illustrarlo utilizzando l'esempio del cloruro di sodio fuso (NaCl).
Passo 1: Applicazione della tensione
Viene applicata una tensione esterna. La fonte di alimentazione spinge gli elettroni verso un elettrodo, rendendolo carico negativamente (il catodo), e attira gli elettroni lontano dall'altro, rendendolo carico positivamente (l'anodo).
Passo 2: Migrazione degli ioni
All'interno dell'elettrolita di NaCl fuso, il sodio esiste come ioni positivi (cationi, Na⁺) e il cloruro esiste come ioni negativi (anioni, Cl⁻).
Gli opposti si attraggono: i cationi Na⁺ positivi sono attratti verso il catodo negativo, mentre gli anioni Cl⁻ negativi sono attratti verso l'anodo positivo.
Passo 3: Riduzione al catodo (l'elettrodo negativo)
Quando i cationi Na⁺ raggiungono il catodo carico negativamente, ciascuno acquista un elettrone fornito dalla fonte di alimentazione. Questo guadagno di elettroni è una reazione di riduzione.
Gli ioni Na⁺ vengono ridotti per formare sodio metallico neutro (Na), che si deposita sul catodo.
Passo 4: Ossidazione all'anodo (l'elettrodo positivo)
Contemporaneamente, quando gli anioni Cl⁻ raggiungono l'anodo carico positivamente, ciascuno cede un elettrone all'elettrodo. Questa perdita di elettroni è una reazione di ossidazione.
Gli ioni Cl⁻ vengono ossidati per formare atomi di cloro neutri, che si accoppiano per formare gas cloro (Cl₂) che si allontana dall'anodo gorgogliando. Gli elettroni rilasciati viaggiano attraverso il circuito esterno tornando alla fonte di alimentazione, completando il circuito.
Comprendere i requisiti chiave
L'elettrolisi è potente ma opera in condizioni specifiche. Ignorare questi aspetti può portare a esperimenti falliti o a una errata interpretazione dei risultati.
Non spontanea per natura
Il principio fondamentale è che l'elettrolisi guida una reazione non spontanea. La decomposizione del sale in sodio metallico e gas cloro, ad esempio, richiede un significativo apporto di energia. Senza la tensione esterna, non succederebbe nulla.
La necessità di una tensione sufficiente
La fonte di alimentazione esterna deve fornire una tensione sufficientemente alta da superare il potenziale naturale della reazione chimica. Se la tensione è troppo bassa, non sarà abbastanza forte da forzare la migrazione degli ioni e il trasferimento di elettroni, e la reazione non procederà.
Il materiale dell'elettrodo è importante
Per la semplice decomposizione, si utilizzano elettrodi inerti (come platino o carbonio). Questi materiali facilitano il trasferimento di elettroni senza partecipare essi stessi alla reazione. In altre applicazioni, come la galvanostegia, l'anodo può essere un elettrodo "attivo" progettato per essere ossidato e disciolto nell'elettrolita.
Applicazione agli esempi comuni
I principi dell'elettrolisi sono universali, ma i prodotti specifici dipendono interamente dall'elettrolita utilizzato.
- Se il tuo obiettivo è produrre metalli puri: Utilizza un sale fuso di quel metallo come elettrolita. Il metallo puro verrà ridotto e depositato sul catodo, come si vede nella produzione industriale di sodio e alluminio.
- Se il tuo obiettivo è decomporre l'acqua: Usa acqua con una piccola quantità di acido o sale per migliorare la conduttività. Questo processo produrrà gas idrogeno (H₂) al catodo e gas ossigeno (O₂) all'anodo.
- Se il tuo obiettivo è galvanizzare un oggetto: L'oggetto da placcare è impostato come catodo. Gli ioni metallici dalla soluzione elettrolitica vengono ridotti sulla superficie dell'oggetto, formando un rivestimento metallico sottile e uniforme.
Controllando il flusso di elettroni, possiamo controllare e invertire direttamente i processi chimici, una capacità fondamentale che è alla base di gran parte dell'industria moderna.
Tabella riassuntiva:
| Componente | Ruolo nell'elettrolisi |
|---|---|
| Elettrolita | Fornisce mezzo conduttivo per il movimento degli ioni (es. NaCl fuso). |
| Anodo (Positivo) | Sito di ossidazione; gli anioni perdono elettroni (es. Cl⁻ → Cl₂ gas). |
| Catodo (Negativo) | Sito di riduzione; i cationi acquistano elettroni (es. Na⁺ → Na metallo). |
| Fonte di alimentazione | Fornisce tensione per guidare reazioni non spontanee. |
Hai bisogno di un controllo preciso sui processi elettrochimici? KINTEK è specializzata in attrezzature da laboratorio e materiali di consumo per l'elettrolisi, la galvanostegia e la sintesi di materiali. I nostri affidabili alimentatori, elettrodi e soluzioni elettrolitiche ti aiutano a ottenere risultati coerenti, sia che tu stia decomponendo composti, raffinando metalli o rivestendo superfici. Contatta oggi i nostri esperti per discutere le esigenze specifiche del tuo laboratorio!
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica a Diffusione di Gas Cella di Reazione a Flusso Liquido
- Cella a Flusso Personalizzabile per la Riduzione di CO2 per Ricerca su NRR, ORR e CO2RR
- Custodia per batteria Li-Air per applicazioni di laboratorio
Domande frequenti
- Come viene utilizzata una cella elettrolitica di alta precisione per valutare la resistenza alla corrosione dei metalli? Validare accuratamente i risultati DCT
- Quali sono i vantaggi tecnici dell'utilizzo di reattori PEM per la biomassa gassosa? Miglioramento della stabilità e della purezza
- Come funziona l'elettrodeposizione? Una guida al rivestimento di precisione con l'elettricità
- Quali vantaggi tecnici offrono gli attuali convertitori e l'inversione di polarità? Migliorare la longevità e l'efficienza del sistema EC
- Qual è lo scopo di un sistema di incisione elettrolitica per acciaio inossidabile 310H? Rivela dettagli precisi della microstruttura
- Come aiutano le apparecchiature per l'attacco elettrolitico a identificare le fasi microstrutturali dell'acciaio inossidabile super duplex?
- Cos'è la cella elettrolitica dell'acqua? Il dispositivo che scompone l'acqua in idrogeno e ossigeno
- Perché le finestre dei reattori PEC devono avere un'elevata resistenza meccanica? Garantire sicurezza e integrità nella conversione dell'energia solare



















