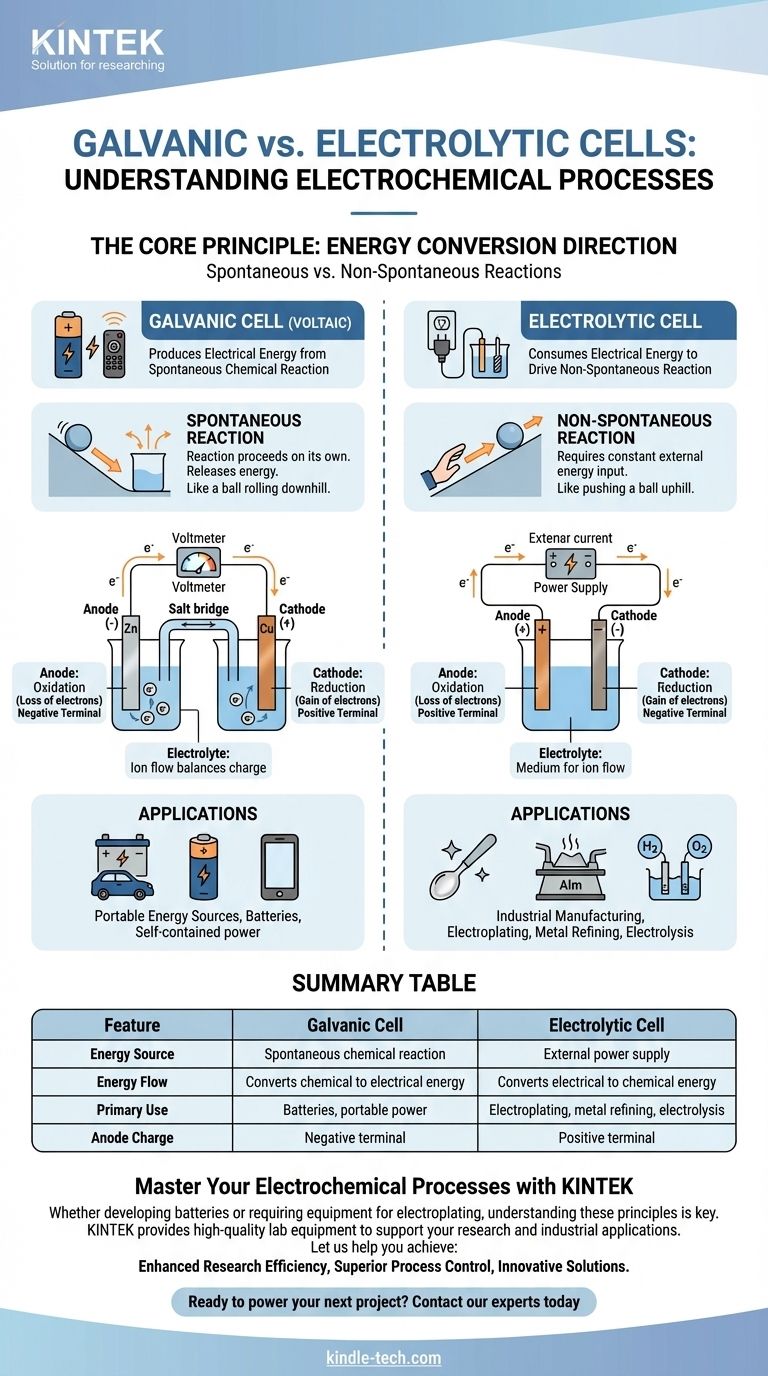
In sostanza, una cella galvanica è una cella elettrochimica che produce energia elettrica da una reazione chimica spontanea, come una batteria che alimenta il tuo telecomando. Al contrario, una cella elettrolitica consuma energia elettrica da una fonte esterna per forzare il verificarsi di una reazione chimica non spontanea, un processo utilizzato nella placcatura e purificazione dei metalli.
La distinzione fondamentale è la direzione della conversione energetica. Una cella galvanica converte l'energia chimica immagazzinata in energia elettrica, mentre una cella elettrolitica converte l'energia elettrica esterna in energia chimica.

Il Principio Fondamentale: Reazioni Spontanee vs. Non Spontanee
Il comportamento di qualsiasi cella elettrochimica è dettato dalla tendenza naturale della sua reazione chimica. Questa tendenza è la chiave per capire perché una cella produce energia e l'altra la richiede.
Come le Celle Galvaniche Generano Energia
Una cella galvanica, nota anche come cella voltaica, è costruita attorno a una reazione chimica spontanea.
Questa è una reazione che procede da sola senza intervento esterno, rilasciando energia nel processo. Pensala come una palla che rotola in discesa.
Questo rilascio di energia spinge gli elettroni attraverso un circuito esterno, creando una corrente elettrica. Questo è il principio alla base di tutte le batterie non ricaricabili e delle batterie ricaricabili in fase di scarica.
Come le Celle Elettrolitiche Consumano Energia
Una cella elettrolitica guida una reazione chimica non spontanea.
Questa è una reazione che non avverrebbe da sola e richiede un apporto costante di energia per procedere. È l'equivalente di spingere una palla in salita.
Una fonte di alimentazione esterna, come un alimentatore, fornisce la tensione necessaria per forzare gli elettroni a fluire contro la loro direzione naturale, guidando il cambiamento chimico desiderato.
Uno Sguardo Pratico alla Funzione della Cella
Sebbene i loro scopi siano opposti, entrambe le celle condividono componenti comuni che operano secondo le stesse regole fondamentali della chimica, ma con una differenza critica nella polarità.
L'Anodo e il Catodo: Un Racconto di Due Polarità
In entrambi i tipi di cella, l'anodo è sempre dove avviene l'ossidazione (perdita di elettroni) e il catodo è dove avviene la riduzione (acquisizione di elettroni).
Tuttavia, la loro carica elettrica è invertita. In una cella galvanica, l'anodo è il terminale negativo perché la reazione spontanea rilascia elettroni da esso.
In una cella elettrolitica, l'anodo è il terminale positivo perché la fonte di alimentazione esterna strappa gli elettroni da esso, forzando l'ossidazione.
Il Ruolo dell'Elettrolita
Entrambe le celle contengono un elettrolita, tipicamente una soluzione contenente ioni.
Questo mezzo è essenziale per completare il circuito elettrico. Mentre gli elettroni fluiscono attraverso il filo esterno, gli ioni fluiscono attraverso l'elettrolita per bilanciare la carica agli elettrodi.
Comprendere le Applicazioni e i Compromessi
Le funzioni opposte di queste celle portano ad applicazioni nel mondo reale e a limitazioni intrinseche molto diverse.
Celle Galvaniche: Fonti di Energia Portatili
L'uso principale delle celle galvaniche è quello di agire come batterie. Forniscono una fonte di alimentazione elettrica portatile e autonoma.
Il compromesso è che i reagenti chimici all'interno della cella sono finiti. Una volta consumati, la cella smette di produrre energia e deve essere smaltita o ricaricata.
Celle Elettrolitiche: Produzione Industriale e Purificazione
Le celle elettrolitiche sono i cavalli di battaglia dell'industria, utilizzate per processi che altrimenti sarebbero chimicamente impossibili o inefficienti.
Le applicazioni chiave includono la placcatura elettrolitica (rivestimento di un metallo con un altro), la raffinazione di metalli come alluminio e rame e l'elettrolisi dell'acqua per produrre idrogeno e ossigeno. Il loro limite principale è la necessità di una fornitura esterna di energia elettrica significativa e continua.
Come Applicare Questa Conoscenza
La tua scelta tra questi concetti dipende interamente dal fatto che il tuo obiettivo sia generare energia o indurre un cambiamento chimico.
- Se il tuo obiettivo principale è generare elettricità da una reazione chimica: Stai lavorando con i principi di una cella galvanica, come quando progetti o comprendi una batteria.
- Se il tuo obiettivo principale è utilizzare l'elettricità per creare un prodotto o raffinare una sostanza: Stai lavorando con i principi di una cella elettrolitica, comune nella produzione chimica e nella metallurgia.
Comprendere questa divisione è il primo passo per padroneggiare l'applicazione pratica dell'elettrochimica.
Tabella Riassuntiva:
| Caratteristica | Cella Galvanica | Cella Elettrolitica |
|---|---|---|
| Fonte di Energia | Reazione chimica spontanea | Alimentatore esterno |
| Flusso di Energia | Converte energia chimica in elettrica | Converte energia elettrica in chimica |
| Uso Principale | Batterie, alimentazione portatile | Placcatura elettrolitica, raffinazione dei metalli, elettrolisi |
| Carica dell'Anodo | Terminale negativo | Terminale positivo |
Padroneggia i tuoi Processi Elettrochimici con KINTEK
Sia che tu stia sviluppando nuove tecnologie per batterie o che tu abbia bisogno di attrezzature precise per la placcatura elettrolitica e la purificazione dei metalli, la comprensione di questi principi elettrochimici fondamentali è solo l'inizio. KINTEK è specializzata nella fornitura di attrezzature e materiali di consumo di alta qualità per supportare la tua ricerca e le tue applicazioni industriali.
Lascia che ti aiutiamo a ottenere:
- Efficienza di Ricerca Migliorata: Con attrezzature affidabili per testare e sviluppare sistemi sia galvanici che elettrolitici.
- Controllo di Processo Superiore: Per risultati coerenti nella placcatura elettrolitica, nell'elettrolisi e nella sintesi dei materiali.
- Soluzioni Innovative: Su misura per le esigenze specifiche di laboratori e impianti di produzione.
Pronto ad alimentare il tuo prossimo progetto? Contatta oggi i nostri esperti per trovare la soluzione perfetta per le tue esigenze di laboratorio!
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrolitica in PTFE Cella Elettrochimica Resistente alla Corrosione Sigillata e Non Sigillata
Domande frequenti
- Qual è la struttura complessiva della cella elettrolitica a bagno d'acqua ottico a doppio strato di tipo H? Design di precisione per esperimenti controllati
- Cos'è una cella di tipo H? Una guida alle celle elettrochimiche divise per esperimenti accurati
- Qual è lo scopo della struttura a doppio strato nella cella elettrolitica di tipo H? Ottenere un controllo termico preciso
- Quali sono i volumi tipici e le configurazioni di apertura per una cella elettrolitica a doppio strato a bagno d'acqua? Ottimizza la tua configurazione elettrochimica
- Quali caratteristiche ottiche presenta la cella elettrolitica di tipo H? Finestrini di quarzo di precisione per la fotoelettrochimica



















