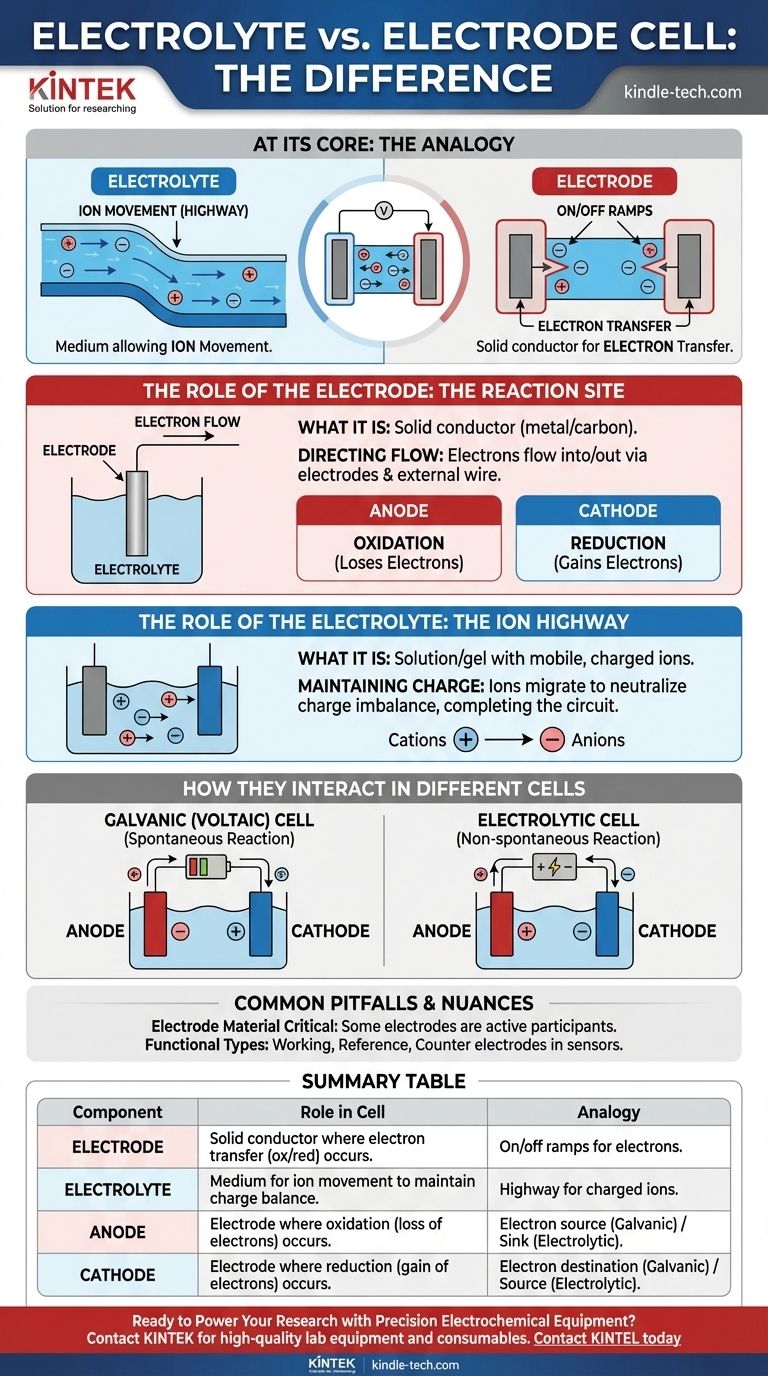
In sostanza, un elettrolita è il mezzo che consente il movimento degli ioni, mentre un elettrodo è il conduttore fisico in cui avviene effettivamente la reazione chimica e il trasferimento di elettroni. L'elettrolita è l'"autostrada" per gli ioni carichi all'interno della cella, e gli elettrodi sono le "rampe di accesso e di uscita" che collegano tale autostrada al circuito elettrico esterno.
In qualsiasi cella elettrochimica, gli elettrodi sono i conduttori solidi dove avvengono reazioni chimiche, rilasciando o consumando elettroni. L'elettrolita è il mezzo liquido o in gel necessario che trasporta gli ioni tra questi elettrodi, completando il circuito elettrico.

Il Ruolo dell'Elettrodo: Il Sito di Reazione
Un elettrodo funge da interfaccia fisica tra i componenti chimici all'interno di una cella e il circuito elettronico esterno.
Cos'è un Elettrodo
Un elettrodo è un conduttore elettrico solido, tipicamente metallico o in carbonio, inserito nell'elettrolita. Il suo compito è trasferire elettroni verso o dalle specie presenti nella soluzione.
Direzione del Flusso di Elettroni
Gli elettroni non possono viaggiare attraverso l'elettrolita. Invece, fluiscono dentro o fuori dalla cella attraverso gli elettrodi e il filo esterno collegato.
Anodo vs. Catodo
Tutte le celle hanno due tipi di elettrodi definiti dalla reazione che avviene sulla loro superficie:
- L'anodo è dove avviene l'ossidazione (una sostanza perde elettroni).
- Il catodo è dove avviene la riduzione (una sostanza acquista elettroni).
Il Ruolo dell'Elettrolita: L'Autostrada Ionica
L'elettrolita è altrettanto cruciale quanto gli elettrodi. Senza di esso, il circuito è incompleto e nessuna corrente può fluire.
Cos'è un Elettrolita
Un elettrolita è una sostanza, tipicamente una soluzione contenente sali, acidi o basi, che produce una soluzione elettricamente conduttiva quando disciolta. Contiene ioni mobili e carichi.
Mantenimento della Neutralità di Carica
Poiché gli elettroni vengono rilasciati all'anodo e consumati al catodo, uno squilibrio di carica si accumulerebbe rapidamente e fermerebbe la reazione. L'elettrolita previene ciò consentendo ai suoi ioni di migrare tra gli elettrodi, neutralizzando la carica e permettendo al processo di continuare.
Come Interagiscono in Celle Diverse
La carica specifica dell'anodo e del catodo dipende dal fatto che la cella stia generando o consumando elettricità.
Nelle Celle Galvaniche (Voltaiche)
Queste celle, come le comuni batterie, convertono l'energia chimica in energia elettrica attraverso una reazione spontanea.
- L'anodo è negativo, poiché è la fonte di elettroni per il circuito esterno.
- Il catodo è positivo, poiché è dove gli elettroni ritornano alla cella.
Nelle Celle Elettrolitiche
Queste celle utilizzano energia elettrica esterna per guidare una reazione non spontanea, come nella galvanostegia o nella scissione dell'acqua.
- L'anodo è positivo, poiché è collegato al terminale positivo della sorgente di alimentazione esterna per allontanare gli elettroni.
- Il catodo è negativo, poiché è collegato al terminale negativo per forzarvi elettroni.
Trappole Comuni e Sfumature
Comprendere le definizioni di base è il primo passo. Riconoscere le sfumature è ciò che porta alla vera comprensione.
Il Materiale dell'Elettrodo è Critico
L'elettrodo non è sempre solo un conduttore inerte. In molte batterie, il materiale dell'elettrodo stesso è un partecipante attivo nella reazione chimica, come l'involucro di zinco di una batteria alcalina che funge da anodo.
Tipi di Elettrodi Funzionali
In chimica analitica e nelle applicazioni di sensori, agli elettrodi vengono dati nomi più specifici in base alla loro funzione.
- Un elettrodo di lavoro è dove avviene la reazione chimica di interesse.
- Un elettrodo di riferimento fornisce un potenziale stabile e costante rispetto al quale misurare.
- Un elettrodo ausiliario completa il circuito, facendo passare corrente all'elettrodo di lavoro.
Fare la Distinzione Giusta per il Tuo Obiettivo
Per applicare questa conoscenza, concentrati sul ruolo fondamentale che ogni componente svolge nel tuo contesto specifico.
- Se il tuo obiettivo principale è la scienza di base delle batterie: considera l'elettrodo come il sito di guadagno/perdita di elettroni (anodo/catodo) e l'elettrolita come l'essenziale trasportatore di ioni che mantiene la batteria in funzione.
- Se il tuo obiettivo principale è eseguire l'elettrolisi: ricorda che la polarità (+/-) degli elettrodi è invertita rispetto a una batteria, ma i loro ruoli chimici fondamentali (anodo=ossidazione, catodo=riduzione) rimangono esattamente gli stessi.
- Se il tuo obiettivo principale è costruire sensori elettrochimici: devi distinguere tra l'elettrodo di lavoro (dove avviene l'evento), l'elettrodo di riferimento (per una misurazione stabile) e l'elettrodo ausiliario (per completare il circuito).
In definitiva, l'elettrodo e l'elettrolita sono due componenti distinti ma inseparabili che costituiscono la base di tutta la tecnologia elettrochimica.
Tabella Riassuntiva:
| Componente | Ruolo in una Cella Elettrochimica | Analogia |
|---|---|---|
| Elettrodo | Conduttore solido dove avviene il trasferimento di elettroni (ossidazione/riduzione). | Rampe di accesso/uscita per gli elettroni verso il circuito esterno. |
| Elettrolita | Mezzo (liquido/gel) che consente il movimento degli ioni per mantenere l'equilibrio di carica. | Autostrada per gli ioni carichi all'interno della cella. |
| Anodo | Elettrodo dove avviene l'ossidazione (perdita di elettroni). | Sorgente di elettroni (Galvanica) o pozzo di elettroni (Elettrolitica). |
| Catodo | Elettrodo dove avviene la riduzione (acquisizione di elettroni). | Destinazione degli elettroni (Galvanica) o sorgente di elettroni (Elettrolitica). |
Pronto ad alimentare la tua ricerca con apparecchiature elettrochimiche di precisione?
Comprendere i fondamenti è il primo passo. Applicarli con gli strumenti giusti è ciò che guida la scoperta. Sia che tu stia sviluppando nuovi materiali per batterie, eseguendo elettrolisi precise o costruendo sensori sensibili, KINTEK fornisce le apparecchiature e i materiali di consumo di laboratorio di alta qualità di cui hai bisogno.
Siamo specializzati nel soddisfare le esigenze precise dei laboratori. Lascia che ti aiutiamo a selezionare le celle elettrochimiche, gli elettrodi e gli elettroliti perfetti per garantire risultati accurati e affidabili per la tua applicazione specifica.
Contatta KINTEL oggi stesso per discutere le esigenze del tuo progetto e scoprire come le nostre soluzioni possono migliorare le capacità del tuo laboratorio!
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Celle di prova personalizzabili tipo Swagelok per la ricerca avanzata sulle batterie e l'analisi elettrochimica
Domande frequenti
- Quali sono i vantaggi delle celle elettrolitiche a tre elettrodi? Analisi di precisione per elettrodi LTO/LPSC e Nb2O5/LPSC
- Come si pulisce la cella elettrolitica a cinque porte a bagno d'acqua per la manutenzione? Una guida passo-passo per risultati affidabili
- Come contribuiscono le celle elettrolitiche alla separazione degli anodi di grafite? Sblocca il riciclo di batterie ad alta purezza
- Perché le membrane polimeriche di acido perfluorosolfonico (PFSA) sono utilizzate come elettroliti nell'elettrolisi PEM?
- Qual è la procedura corretta per installare gli elettrodi e la membrana a scambio ionico nella cella elettrolitica di tipo H?
- Come devono essere pulite regolarmente la cella elettrolitica e i suoi elettrodi per la manutenzione? Una guida per risultati affidabili
- Qual è la funzione principale di una cella elettrolitica nella determinazione del trizio? Migliorare il rilevamento tramite l'arricchimento del campione
- Quali ispezioni regolari sono richieste per una cella elettrolitica a bagno d'acqua a cinque porte? Garantire risultati elettrochimici coerenti



















