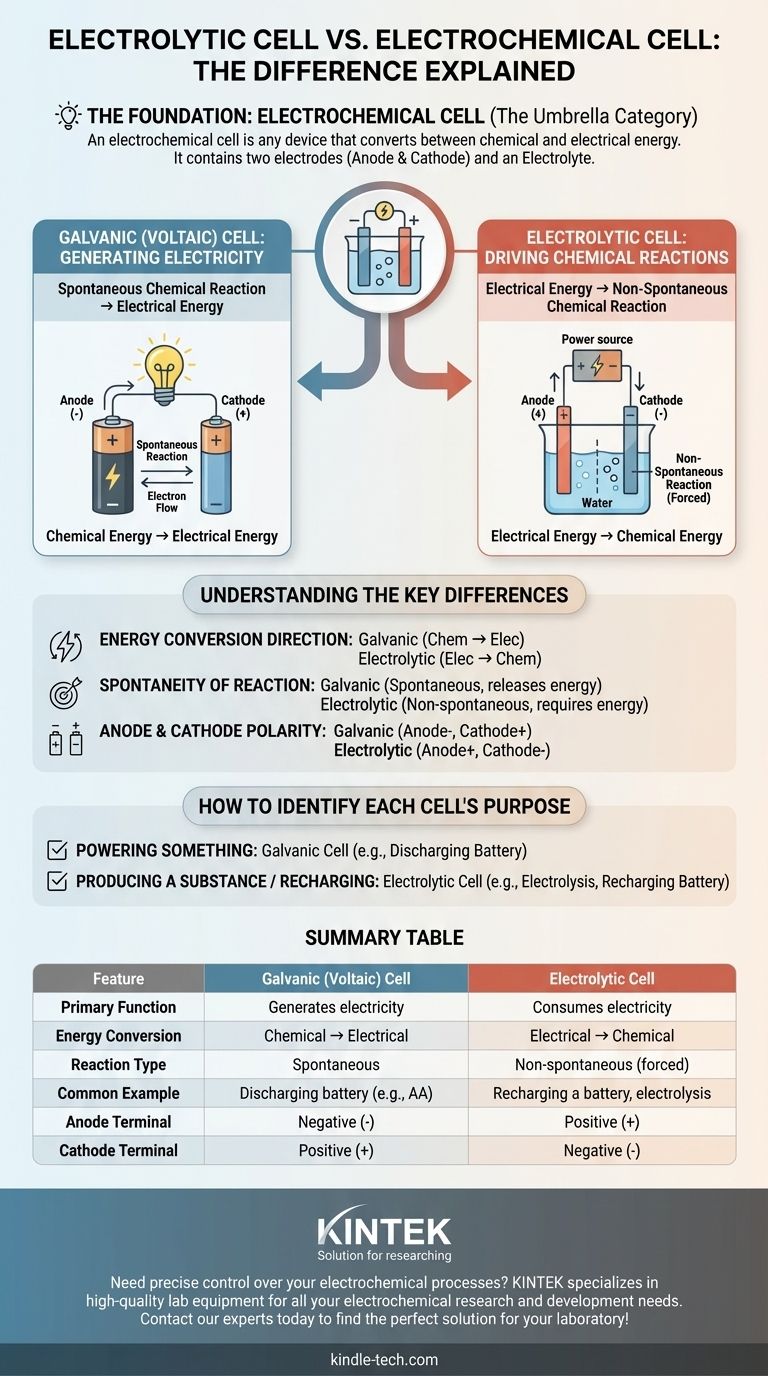
La principale fonte di confusione è che una cella elettrolitica non è un concetto separato da una cella elettrochimica — è uno dei due principali tipi di celle elettrochimiche. Una cella elettrochimica è la categoria ampia per qualsiasi dispositivo che converte energia chimica in energia elettrica e viceversa. La vera distinzione risiede tra le celle galvaniche (voltaiche), che generano elettricità da reazioni chimiche, e le celle elettrolitiche, che usano l'elettricità per causare reazioni chimiche.
Il termine cella elettrochimica è la categoria ombrello. I due tipi specifici sotto questo ombrello sono le celle galvaniche (che creano elettricità) e le celle elettrolitiche (che consumano elettricità). La loro differenza fondamentale è la direzione della conversione energetica.

Le Basi: Cos'è una Cella Elettrochimica?
Componenti Fondamentali
Una cella elettrochimica è qualsiasi dispositivo contenente due elettrodi (un anodo e un catodo) e un elettrolita. Questi componenti lavorano insieme per facilitare il trasferimento di elettroni, creando o consumando una corrente elettrica.
Lo Scopo Generale
L'unico scopo di una cella elettrochimica è servire da ponte tra l'energia chimica e l'energia elettrica. La direzione di questa conversione energetica determina il tipo specifico di cella.
I Due Tipi Fondamentali di Conversione
Celle Galvaniche (Voltaiche): Generazione di Elettricità
Una cella galvanica, conosciuta anche come cella voltaica, sfrutta una reazione chimica spontanea per produrre energia elettrica.
Pensa a una comune batteria AA. I materiali chimici al suo interno reagiscono naturalmente, rilasciando energia sotto forma di corrente elettrica che può alimentare un dispositivo. Questa è una cella galvanica in azione.
Celle Elettrolitiche: Indurre Reazioni Chimiche
Una cella elettrolitica fa esattamente l'opposto. Utilizza una fonte esterna di energia elettrica (come un alimentatore) per forzare una reazione chimica non spontanea a verificarsi.
Un esempio comune è l'elettrolisi, come la scissione dell'acqua in idrogeno e ossigeno. Questa reazione non avviene da sola; richiede un apporto costante di elettricità, che è la funzione della cella elettrolitica. La ricarica di una batteria è un altro esempio di questo processo.
Comprendere le Differenze Chiave
Direzione della Conversione Energetica
Questa è la distinzione più critica. Una cella galvanica converte l'energia chimica immagazzinata in energia elettrica. Una cella elettrolitica converte l'energia elettrica fornita in energia chimica.
Spontaneità della Reazione
La reazione chimica in una cella galvanica è spontanea — procede naturalmente e rilascia energia.
La reazione in una cella elettrolitica è non spontanea — richiede un apporto costante di energia esterna per procedere.
Polarità di Anodo e Catodo
Questo è un punto comune di confusione ma segue logicamente dal flusso di energia.
In una cella galvanica (batteria che si scarica), l'anodo è la fonte di elettroni, rendendolo il terminale negativo, mentre il catodo è il terminale positivo.
In una cella elettrolitica (batteria in ricarica), una fonte di alimentazione esterna inverte il flusso. L'anodo è dove avviene ancora l'ossidazione ma è costretto ad essere il terminale positivo, e il catodo è il terminale negativo.
Come Identificare lo Scopo di Ogni Cella
Usa la funzione primaria della cella come guida per distinguere facilmente tra i due tipi.
- Se l'obiettivo primario è alimentare qualcosa: Stai usando una cella galvanica (voltaica), poiché una reazione chimica spontanea sta producendo elettricità.
- Se l'obiettivo primario è produrre una sostanza o ricaricare una batteria: Stai usando una cella elettrolitica, poiché l'elettricità viene consumata per forzare una reazione chimica.
In definitiva, entrambe sono semplicemente due facce della stessa medaglia elettrochimica, definite dal fatto che generino o consumino energia elettrica.
Tabella Riassuntiva:
| Caratteristica | Cella Galvanica (Voltaica) | Cella Elettrolitica |
|---|---|---|
| Funzione Primaria | Genera elettricità | Consuma elettricità |
| Conversione Energetica | Chimica → Elettrica | Elettrica → Chimica |
| Tipo di Reazione | Spontanea | Non spontanea (forzata) |
| Esempio Comune | Batteria che si scarica (es. AA) | Ricarica di una batteria, elettrolisi |
| Terminale Anodo | Negativo (-) | Positivo (+) |
| Terminale Catodo | Positivo (+) | Negativo (-) |
Hai bisogno di un controllo preciso sui tuoi processi elettrochimici? KINTEK è specializzata in attrezzature da laboratorio di alta qualità per tutte le tue esigenze di ricerca e sviluppo elettrochimico. Che tu stia sviluppando nuove tecnologie per batterie o sintetizzando materiali tramite elettrolisi, i nostri strumenti affidabili garantiscono risultati accurati e riproducibili. Contatta i nostri esperti oggi stesso per trovare la soluzione perfetta per il tuo laboratorio!
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrolitica in PTFE Cella Elettrochimica Resistente alla Corrosione Sigillata e Non Sigillata
Domande frequenti
- Qual è il ruolo primario di un sistema di cella elettrolitica a tre elettrodi? Ottenere precisione nell'ossidazione dei semiconduttori
- Qual è l'importanza della polarità degli elettrodi durante l'allestimento della cella elettrolitica? Padroneggia le tue reazioni chimiche
- In che modo il design di una cella elettrolitica influenza la sintesi di nanotubi di ossido metallico? Suggerimenti esperti per l'ottimizzazione delle celle
- Qual è la funzione di una cella elettrolitica a membrana scambiabile di tipo H? Padroneggiare il controllo preciso delle reazioni
- Quali sono gli svantaggi del metodo di elettrodeposizione? Limitazioni chiave per il rivestimento dei materiali
- Perché un sistema a cella elettrochimica a tre elettrodi è necessario per la cinetica di corrosione delle leghe Ni-Cr? Analisi Esperta
- Come è conosciuta anche una cella elettrolitica? Comprendere le celle elettrolitiche vs. galvaniche
- Qual è la funzione di una cella elettrolitica nell'arricchimento del trizio? Potenziamento del rilevamento per analisi a basso livello



















