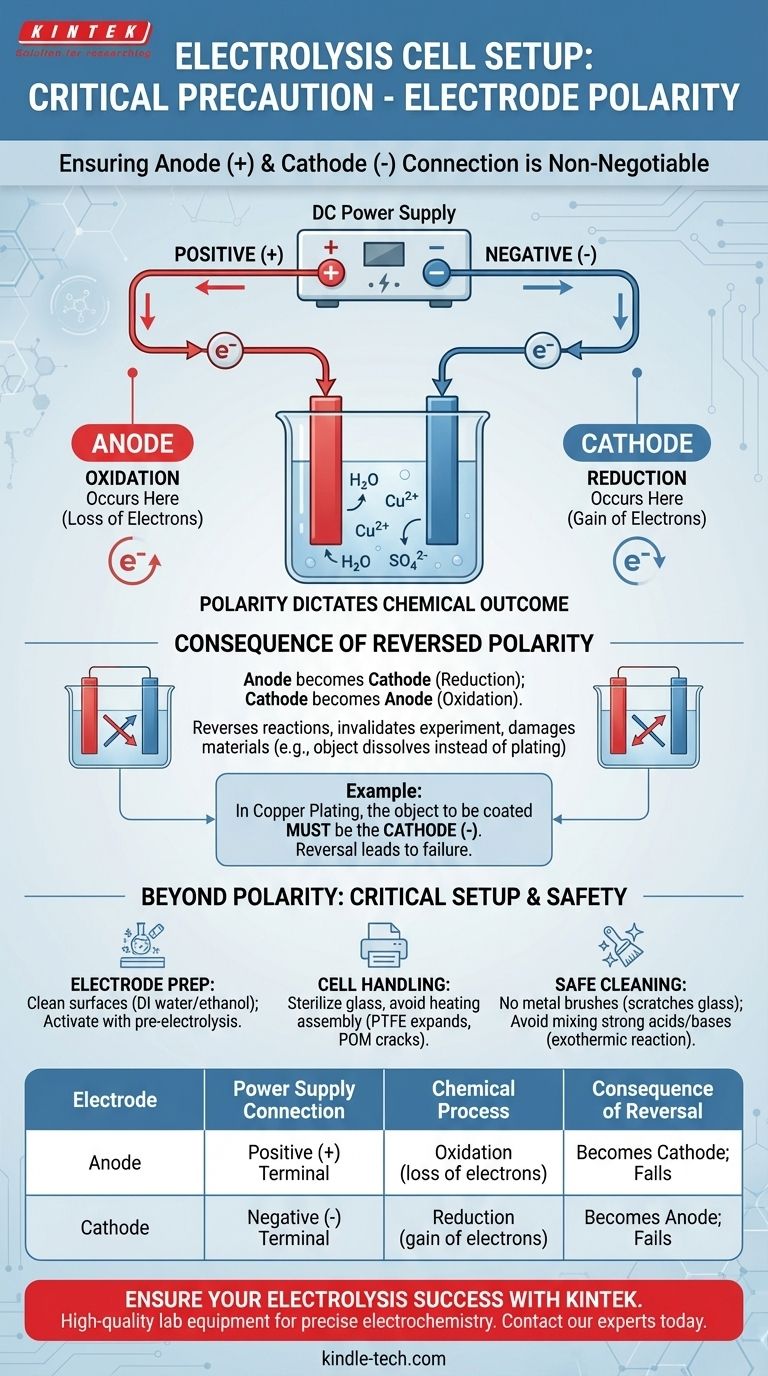
La precauzione più critica riguardo alla polarità degli elettrodi è assicurarsi che l'anodo sia collegato al terminale positivo (+) del vostro alimentatore di corrente continua (DC) e che il catodo sia collegato al terminale negativo (-). Questa assegnazione è assoluta e determina l'intero esito chimico del vostro esperimento. Invertire questo collegamento invertirà le reazioni previste su ciascun elettrodo, portando a prodotti errati e potenziali danni ai materiali.
Impostare correttamente la polarità degli elettrodi non è solo un passaggio procedurale; è l'atto fondamentale di definire quale reazione chimica—ossidazione o riduzione—avverrà su ciascuna superficie. Sbagliare questo aspetto invalida l'intero scopo dell'elettrolisi.

Perché la Polarità è Non Negoziabile nell'Elettrolisi
Una cella elettrolitica utilizza energia elettrica per guidare una reazione chimica non spontanea. La polarità della sorgente di alimentazione detta quale elettrodo forza una specie chimica a perdere elettroni (ossidazione) e quale forza una specie ad acquisirli (riduzione).
Il Ruolo dell'Anodo (Ossidazione)
L'anodo è, per definizione, l'elettrodo dove avviene l'ossidazione. Per forzare una sostanza a perdere i suoi elettroni, è necessario collegare questo elettrodo al terminale positivo (+) dell'alimentatore DC. Il terminale positivo attira attivamente gli elettroni lontano dall'anodo e nel circuito esterno.
Il Ruolo del Catodo (Riduzione)
Il catodo è l'elettrodo dove avviene la riduzione. Per forzare una sostanza ad acquisire elettroni, è necessario collegare questo elettrodo al terminale negativo (-) dell'alimentatore. Il terminale negativo spinge attivamente gli elettroni dal circuito esterno sulla superficie del catodo, dove possono essere accettati dall'elettrolita.
La Conseguenza della Polarità Invertita
Se si scambiano inavvertitamente i collegamenti, l'elettrodo che si intendeva fosse l'anodo diventa il catodo, e viceversa. Le reazioni fondamentali vengono invertite in ciascuna posizione.
Ad esempio, nella placcatura in rame, si desidera depositare rame (Cu²⁺ + 2e⁻ → Cu) su un oggetto. L'oggetto deve essere il catodo (terminale negativo). Se lo si collega al terminale positivo, potrebbe iniziare a dissolversi.
Oltre la Polarità: Precauzioni Critiche di Allestimento e Sicurezza
Un esperimento di successo dipende da più della semplice corretta polarità. Lo stato fisico e chimico della cella e degli elettrodi è altrettanto importante per ottenere risultati affidabili e sicuri.
Preparazione e Attivazione degli Elettrodi
Pulire sempre le superfici degli elettrodi prima di un esperimento, tipicamente con acqua deionizzata o etanolo, per rimuovere eventuali impurità organiche o polvere.
Per alcuni materiali, una breve "pre-elettrolisi" nell'elettrolita può aiutare ad attivare la superficie rimuovendo eventuali strati di ossido passivante che potrebbero interferire con la reazione primaria.
Gestione della Cella e Limiti dei Materiali
I componenti in vetro di una cella possono spesso essere sterilizzati sotto vapore ad alta pressione (121℃), ma l'intero assemblaggio non deve mai essere riscaldato.
Materiali come il PTFE (Teflon) possono espandersi permanentemente se riscaldati, e il POM (poliacetale) può creparsi. Questi limiti termici sono fondamentali da rispettare per evitare di danneggiare la cella.
Procedure di Pulizia Sicure
Non usare mai spazzole metalliche per pulire l'interno di una cella di vetro, poiché possono creare graffi microscopici che indeboliscono il vetro e creano siti di contaminazione.
Evitare di mescolare acidi forti e basi (come acido nitrico e idrossido di sodio) per la pulizia. Ciò può causare una reazione violenta ed esotermica (che genera calore) estremamente pericolosa.
Fare la Scelta Giusta per il Vostro Obiettivo
Verificate sempre i vostri collegamenti rispetto all'obiettivo sperimentale. Il ruolo di ciascun elettrodo è definito da ciò che dovete realizzare.
- Se il vostro obiettivo principale è la galvanostegia o la deposizione: L'oggetto che volete rivestire deve essere il catodo, collegato al terminale negativo (-).
- Se il vostro obiettivo principale è generare gas specifici da un elettrolita: Ricordate che l'idrogeno (dalla riduzione di H⁺) viene prodotto al catodo (-) e l'ossigeno (dall'ossidazione di H₂O o OH⁻) viene prodotto all'anodo (+).
- Se il vostro obiettivo principale è l'elettrosintesi o la purificazione: La polarità determina quale materiale di partenza viene ossidato all'anodo (+) e quale viene ridotto al catodo (-), quindi deve essere impostata in base al percorso di reazione desiderato.
In definitiva, la corretta polarità assicura che stiate guidando il cambiamento chimico specifico che intendete studiare o produrre.
Tabella Riassuntiva:
| Elettrodo | Collegamento all'Alimentatore | Processo Chimico | Conseguenza dell'Inversione |
|---|---|---|---|
| Anodo | Terminale Positivo (+) | Ossidazione (perdita di elettroni) | Diventa il catodo; la reazione di ossidazione prevista fallisce |
| Catodo | Terminale Negativo (-) | Riduzione (acquisizione di elettroni) | Diventa l'anodo; la reazione di riduzione prevista fallisce |
Assicuratevi che i vostri esperimenti di elettrolisi abbiano successo ogni volta. La corretta polarità è solo un aspetto di un allestimento di laboratorio appropriato. KINTEK è specializzata in attrezzature e materiali di consumo di laboratorio di alta qualità, fornendo gli strumenti affidabili di cui avete bisogno per un'elettrochimica, una sintesi e un'analisi precise. Contattate oggi i nostri esperti per discutere le vostre specifiche esigenze di laboratorio e scoprire come le nostre soluzioni possono migliorare l'efficienza e la sicurezza della vostra ricerca.
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrochimica Elettrolitica a Bagno d'Acqua a Doppio Strato
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrolitica in PTFE Cella Elettrochimica Resistente alla Corrosione Sigillata e Non Sigillata
Domande frequenti
- Quali sono i volumi e le dimensioni disponibili per la cella elettrolitica interamente in quarzo? Trova la soluzione perfetta per il tuo laboratorio
- Quali sono i passaggi necessari per preparare una cella elettrolitica interamente in quarzo prima di un esperimento? Garantire precisione e sicurezza
- Qual è la procedura corretta per la pulizia post-esperimento e la conservazione di una cella elettrolitica interamente in quarzo? Garantire longevità e riproducibilità
- Quali precauzioni devono essere adottate durante la manipolazione e l'uso di una cella elettrolitica interamente in quarzo? Garantire prestazioni sicure, accurate e durature
- Quali sono le procedure operative e le precauzioni di sicurezza durante un esperimento che utilizza una cella elettrolitica interamente in quarzo? Garantisci sicurezza e precisione nel tuo laboratorio



















