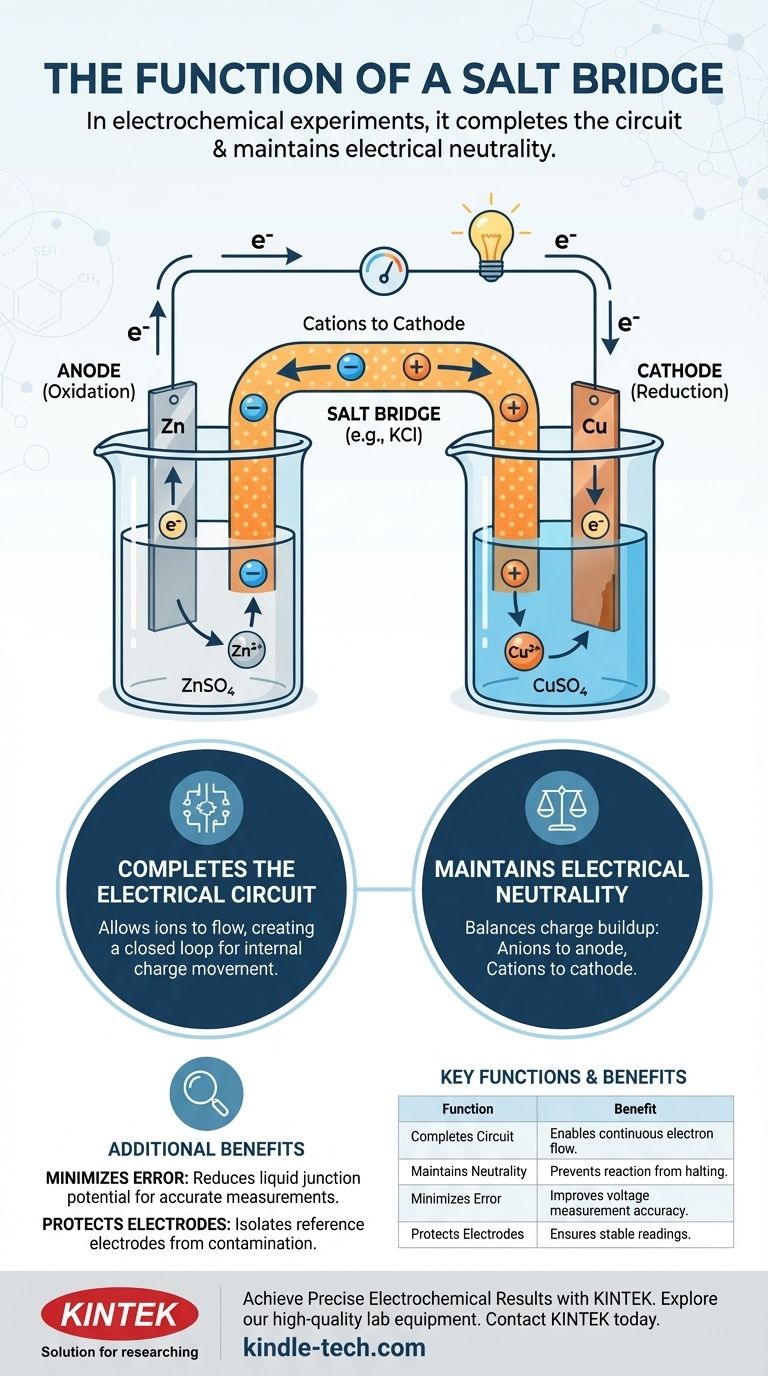
Negli esperimenti elettrochimici, un ponte salino svolge due funzioni principali: completa il circuito elettrico consentendo agli ioni di fluire tra le due semicelle e mantiene la neutralità elettrica in ciascuna semicella. Senza questo componente cruciale, la carica si accumulerebbe rapidamente, bloccando il flusso di elettroni e interrompendo quasi istantaneamente la reazione elettrochimica.
Un ponte salino non è solo un connettore; è il meccanismo di bilanciamento della carica che rende possibile una reazione elettrochimica sostenuta. Funziona internamente, muovendo ioni per contrastare lo squilibrio di carica creato dagli elettroni che si muovono esternamente.

L'Anatomia di una Cella Elettrochimica
Per comprendere la funzione di un ponte salino, devi prima visualizzare il sistema in cui opera. Una cella elettrochimica è fondamentalmente un dispositivo che converte l'energia chimica in energia elettrica, o viceversa.
Le Due Semicelle
Una cella elettrochimica è composta da due semicelle. Ciascuna semicella contiene tipicamente un elettrodo (un conduttore solido come zinco o rame) immerso in una soluzione elettrolitica (una soluzione contenente ioni, come solfato di zinco o solfato di rame).
In una semicella si verifica l'ossidazione (perdita di elettroni) e questo elettrodo è chiamato anodo. Nell'altra si verifica la riduzione (acquisizione di elettroni) e questo elettrodo è il catodo.
Il Problema: Accumulo Immediato di Carica
Gli elettroni generati all'anodo viaggiano attraverso un filo esterno fino al catodo, creando una corrente elettrica. Tuttavia, questo flusso di elettroni crea un problema immediato.
Mentre l'anodo perde elettroni, la sua soluzione elettrolitica accumula un eccesso di ioni positivi. Al contrario, mentre il catodo acquisisce elettroni, la sua soluzione elettrolitica sviluppa un eccesso di ioni negativi (poiché gli ioni positivi della soluzione vengono consumati). Questa separazione di carica crea una potente tensione opposta che arresta completamente il flusso di elettroni.
Le Funzioni Principali di un Ponte Salino
Il ponte salino è l'elegante soluzione a questo problema di accumulo di carica. È tipicamente un tubo a forma di U riempito con una soluzione concentrata di un elettrolita inerte, come cloruro di potassio (KCl) o nitrato di potassio (KNO₃).
Completare il Circuito Elettrico
Un circuito elettrico completo richiede un anello chiuso. Il filo esterno consente il flusso di elettroni, ma questa è solo metà del circuito. Il ponte salino completa l'anello consentendo agli ioni di fluire tra le semicelle, creando un percorso per il movimento interno della carica.
Mantenere la Neutralità Elettrica
Questa è la funzione più critica del ponte salino. Per neutralizzare la carica accumulata:
- Gli anioni (ioni negativi) provenienti dal ponte salino migrano nella semicella anodica per bilanciare l'eccesso di ioni positivi che si stanno creando.
- I cationi (ioni positivi) provenienti dal ponte salino migrano nella semicella catodica per bilanciare l'eccesso di carica negativa.
Bilanciando costantemente la carica in entrambe le semicelle, il ponte salino assicura che la reazione elettrochimica possa procedere e che possa essere mantenuta una corrente costante.
Minimizzare il Potenziale di Giunzione Liquida
Nelle misurazioni più precise, il ponte salino serve anche a ridurre il potenziale di giunzione liquida. Questa è una piccola tensione indesiderata che si forma all'interfaccia di due diverse soluzioni elettrolitiche. Creando un ponte ionico più graduale, minimizza questa fonte di errore, portando a misurazioni di potenziale della cella più accurate.
Comprendere le Considerazioni Pratiche
L'efficacia di un ponte salino dipende interamente dalla sua composizione e interazione con il resto della cella.
L'Elettrolita Deve Essere Inerte
Gli ioni all'interno del ponte salino non devono reagire con gli ioni presenti nella soluzione di ciascuna semicella. Ad esempio, usare un ponte salino a base di KCl in una cella contenente nitrato d'argento (AgNO₃) sarebbe un errore. Gli ioni cloruro (Cl⁻) reagirebbero con gli ioni argento (Ag⁺) formando un precipitato solido (AgCl), interrompendo la funzione della cella.
Proteggere l'Elettrodo di Riferimento
In un setup a tre elettrodi comune in elettrochimica, un ponte salino viene spesso utilizzato per collegare un elettrodo di riferimento (che ha un potenziale costante e noto) alla soluzione principale. Ciò viene fatto per isolare l'elettrodo di riferimento, impedendo agli ioni della soluzione di prova di contaminarlo e alterare il suo potenziale stabile. Ciò prolunga la vita utile dell'elettrodo e garantisce l'accuratezza della misurazione.
Fare la Scelta Giusta per il Tuo Esperimento
Il ruolo principale del ponte salino è sempre quello di facilitare il flusso ionico, ma la sua importanza può essere vista attraverso diverse lenti a seconda del tuo obiettivo.
- Se il tuo obiettivo principale è una semplice dimostrazione di cella galvanica: Pensa al ponte salino come al componente che completa il circuito e permette alla batteria di funzionare continuamente.
- Se il tuo obiettivo principale è la misurazione precisa della tensione: Il ponte salino è fondamentale per minimizzare il potenziale di giunzione liquida, che è una fonte chiave di errore sperimentale.
- Se il tuo obiettivo principale è l'elettrochimica analitica (ad esempio, studi sulla corrosione): Il ponte salino è essenziale per isolare il tuo elettrodo di riferimento per garantire una base stabile e affidabile per le tue letture di potenziale.
In definitiva, il ponte salino consente lo studio controllato e continuo delle reazioni elettrochimiche risolvendo il problema fondamentale della separazione di carica.
Tabella Riassuntiva:
| Funzione | Descrizione | Vantaggio Chiave |
|---|---|---|
| Completa il Circuito | Consente il flusso di ioni tra le semicelle. | Abilita il flusso continuo di elettroni. |
| Mantiene la Neutralità | Bilancia l'accumulo di carica dal trasferimento di elettroni. | Impedisce l'arresto della reazione. |
| Minimizza l'Errore | Riduce il potenziale di giunzione liquida. | Migliora l'accuratezza della misurazione della tensione. |
| Protegge gli Elettrodi | Isola gli elettrodi di riferimento dalla contaminazione. | Garantisce letture stabili e affidabili. |
Pronto a ottenere risultati precisi e affidabili nei tuoi esperimenti elettrochimici? La strumentazione giusta è fondamentale per il tuo successo. KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità, incluse celle elettrochimiche e accessori progettati per accuratezza e durata. Lascia che i nostri esperti ti aiutino a selezionare la configurazione perfetta per le tue esigenze di ricerca.
Contatta KINTEK oggi stesso per discutere come possiamo supportare le capacità elettrochimiche del tuo laboratorio!
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Bagno d'acqua a doppio strato a cinque porte Cella elettrolitica elettrochimica
- Cella Elettrolitica in PTFE Cella Elettrochimica Resistente alla Corrosione Sigillata e Non Sigillata
Domande frequenti
- Come viene utilizzata una cella elettrolitica di alta precisione per valutare la resistenza alla corrosione dei metalli? Validare accuratamente i risultati DCT
- Quali sono i vantaggi di una cella elettrochimica piana per la corrosione? Ottenere un'analisi precisa di vaiolatura e interstizi
- Qual è il principio di funzionamento di una cella elettrolitica per la corrosione a piastra piana? Una guida ai test sui materiali controllati
- Come viene utilizzata una cella elettrolitica elettrochimica a tre elettrodi per valutare la resistenza alla corrosione della lega Zr-Nb?
- Quale ruolo svolge una cella elettrolitica con camicia d'acqua nelle misurazioni di corrosione elettrochimica a temperatura variabile?


















