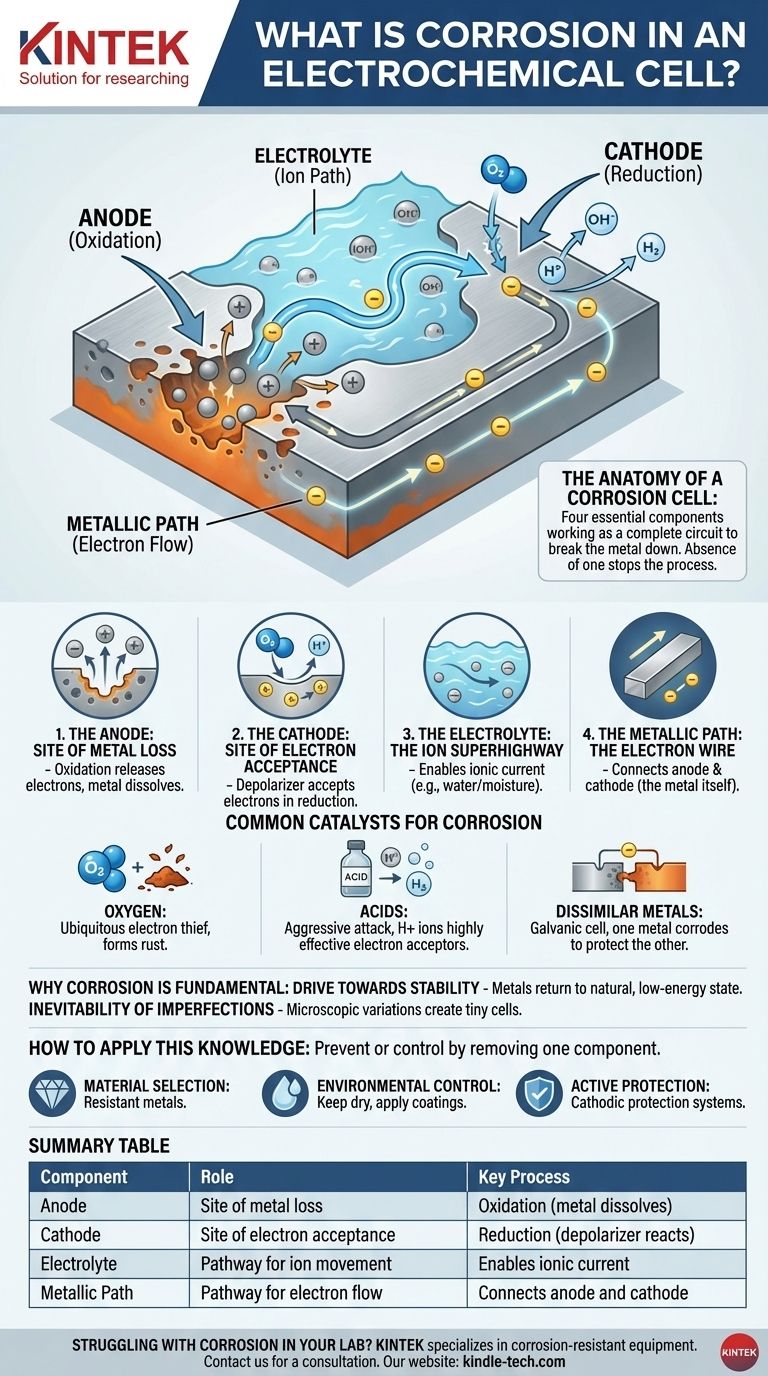
Nella sua essenza, la corrosione è il degrado naturale di un metallo raffinato in una forma chimicamente più stabile, come il suo ossido o solfuro. All'interno di una cella elettrochimica, questo processo non è semplicemente una reazione superficiale, ma un circuito completo in cui il metallo si autodistrugge creando una minuscola e indesiderata batteria sulla propria superficie.
La corrosione è un processo elettrochimico perché coinvolge le quattro componenti essenziali di una batteria: un anodo (dove il metallo viene perso), un catodo, un elettrolita (come l'acqua) e un percorso metallico, tutti che lavorano insieme per scomporre il metallo.
L'Anatomia di una Cella di Corrosione
Comprendere la corrosione significa comprendere le quattro componenti necessarie al suo funzionamento. L'assenza di una di queste componenti arresta completamente il processo.
L'Anodo: Il Sito della Perdita di Metallo
Il sito anodico è il punto specifico sulla superficie del metallo dove avviene la corrosione. Qui, gli atomi di metallo subiscono ossidazione, perdendo elettroni e trasformandosi in ioni a carica positiva che si dissolvono nell'acqua o nell'umidità circostante. Questo è l'atto fisico in cui il metallo viene consumato.
Il Catodo: Il Sito di Accettazione degli Elettroni
Gli elettroni rilasciati dall'anodo viaggiano attraverso il metallo fino a una posizione diversa, il sito catodico. Qui, una sostanza nell'ambiente—nota come depolarizzatore—accetta questi elettroni in una reazione di riduzione. Questo depolarizzatore è un ingrediente critico.
L'Elettrolita: L'Autostrada Ionica
L'acqua, anche in quantità microscopiche come l'umidità, funge da elettrolita. Fornisce un mezzo affinché gli ioni metallici disciolti (dall'anodo) e altri ioni possano viaggiare, completando il circuito elettrico. Senza un elettrolita, gli ioni non hanno modo di muoversi e il circuito si interrompe.
Il Percorso Metallico: Il Filo Elettronico
Il corpo del metallo stesso funge da percorso metallico. Fornisce un percorso conduttivo affinché gli elettroni viaggino dall'anodo al catodo. Ecco perché i siti anodici e catodici possono essere proprio uno accanto all'altro o lontani sullo stesso pezzo di metallo.
Catalizzatori Comuni per la Corrosione
La velocità e la gravità della corrosione sono spesso dettate dalla disponibilità e dal tipo di depolarizzatore (l'accettore di elettroni) al catodo.
Ossigeno: Il Ladro di Elettroni Ubiquitario
Nella maggior parte degli ambienti comuni, l'ossigeno disciolto è il principale accettore di elettroni. Questo è il motivo per cui l'acqua e l'ossigeno insieme sono così distruttivi per i metalli come il ferro, portando alla formazione della ruggine (ossido di ferro).
Acidi: Un Attacco Aggressivo
Gli acidi accelerano drasticamente la corrosione. Gli ioni idrogeno (H+) in una soluzione acida sono accettori di elettroni altamente efficaci, creando idrogeno gassoso al catodo. Questo processo è tipicamente molto più veloce e più aggressivo della corrosione guidata dall'ossigeno.
Metalli Dissimili: La Cella Galvanica
Quando due metalli diversi sono in contatto elettrico all'interno di un elettrolita, creano una cella galvanica. Il metallo meno nobile e più attivo diventerà l'anodo e si corroderà rapidamente, mentre il metallo più nobile diventerà il catodo e sarà protetto. Questo è il motivo per cui si vedono anodi sacrificali di zinco sugli scafi delle barche per proteggere l'acciaio.
Perché la Corrosione è un Processo Fondamentale
La corrosione non è un difetto; è un processo naturale e spontaneo guidato dalle leggi fondamentali della termodinamica. Comprendere questa inevitabilità è fondamentale per gestirla.
La Spinta Verso la Stabilità
I metalli raffinati come l'alluminio e l'acciaio sono materiali artificiali mantenuti in uno stato ad alta energia. La corrosione è semplicemente il processo con cui quel metallo ritorna al suo stato naturale a bassa energia, simile al minerale da cui è stato estratto. Il metallo sta rilasciando la sua energia immagazzinata.
L'Inevitabilità delle Imperfezioni
Nessuna superficie metallica è perfettamente uniforme. Variazioni microscopiche nella composizione, stress dovuto alla fabbricazione o persino differenze nell'esposizione all'ossigeno creano minuscoli siti anodici e catodici su tutta la superficie. Queste imperfezioni sono tutto ciò che serve per avviare migliaia di microscopiche celle di corrosione.
Come Applicare Queste Conoscenze
Capire che la corrosione è una cella elettrochimica ti fornisce un quadro chiaro per prevenirla o controllarla. La strategia è sempre quella di rimuovere una delle quattro componenti essenziali.
- Se il tuo obiettivo principale è la selezione dei materiali: Usa metalli che sono naturalmente resistenti alla formazione di una cella elettrochimica nel loro ambiente di servizio, oppure evita di collegare metalli dissimili.
- Se il tuo obiettivo principale è il controllo ambientale: Elimina l'elettrolita mantenendo il metallo asciutto o applicando un rivestimento impermeabile (come la vernice) per impedire all'umidità di raggiungere la superficie.
- Se il tuo obiettivo principale è la protezione attiva: Crea intenzionalmente una cella elettrochimica più potente in cui il tuo metallo strutturale è costretto ad essere il catodo. Questo è il principio alla base sia degli anodi sacrificali che dei sistemi di protezione catodica.
Visualizzando la corrosione come un semplice circuito, puoi diagnosticare sistematicamente la sua causa e interrompere efficacemente il suo percorso distruttivo.

Tabella Riassuntiva:
| Componente | Ruolo nella Cella di Corrosione | Processo Chiave |
|---|---|---|
| Anodo | Sito di perdita di metallo | Ossidazione (il metallo si dissolve) |
| Catodo | Sito di accettazione degli elettroni | Riduzione (il depolarizzatore reagisce) |
| Elettrolita | Percorso per il movimento degli ioni | Abilita la corrente ionica (es. acqua) |
| Percorso Metallico | Percorso per il flusso di elettroni | Collega anodo e catodo (il metallo stesso) |
Hai problemi di corrosione nelle attrezzature del tuo laboratorio?
La corrosione può compromettere i tuoi esperimenti, danneggiare strumentazioni sensibili e causare costosi tempi di inattività. KINTEK è specializzata in attrezzature e materiali di consumo per laboratori resistenti alla corrosione, aiutandoti a proteggere i tuoi investimenti e a garantire l'integrità della tua ricerca.
I nostri esperti possono aiutarti a selezionare i materiali e le soluzioni giuste per interrompere il circuito di corrosione nel tuo specifico ambiente di laboratorio.
Contatta KINTEK oggi stesso per una consulenza e scopri come possiamo aiutarti a combattere la corrosione e migliorare le prestazioni del tuo laboratorio.
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrochimica per Corrosione Piatta
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica per Elettrolisi Spettrale a Strato Sottile
Domande frequenti
- Quali sono le linee guida chiave per l'uso sicuro della cella elettrolitica di tipo H? Migliori pratiche per il tuo laboratorio
- Qual è la necessità di un sistema di test elettrochimico a temperatura costante? Garantire la precisione nella ricerca sui perovskiti
- Quale ruolo svolge una cella di permeazione elettrochimica a doppia camera nello studio della diffusione dell'idrogeno nell'acciaio al 9% di Cr?
- Come deve essere pulita la cella elettrolitica di tipo H dopo l'uso? Manutenzione esperta per risultati elettrochimici puri
- Quali sono le precauzioni di sicurezza chiave per l'utilizzo di una cella elettrolitica super sigillata? Protocolli Essenziali per la Sicurezza in Laboratorio
- Come fa un sistema di celle elettrochimiche a garantire la precisione della misurazione durante il test di riattivazione potenziocinetica a doppio anello (DL-EPR) dell'acciaio inossidabile super duplex?
- Quali sono i vantaggi dell'utilizzo di apparecchiature di catalisi elettrochimica per i combustibili dall'acqua di mare? Streamlined Marine Energy
- Qual è lo scopo principale dell'introduzione di azoto ad alta purezza nella cella elettrochimica a tre elettrodi durante i test della lega 22?



















