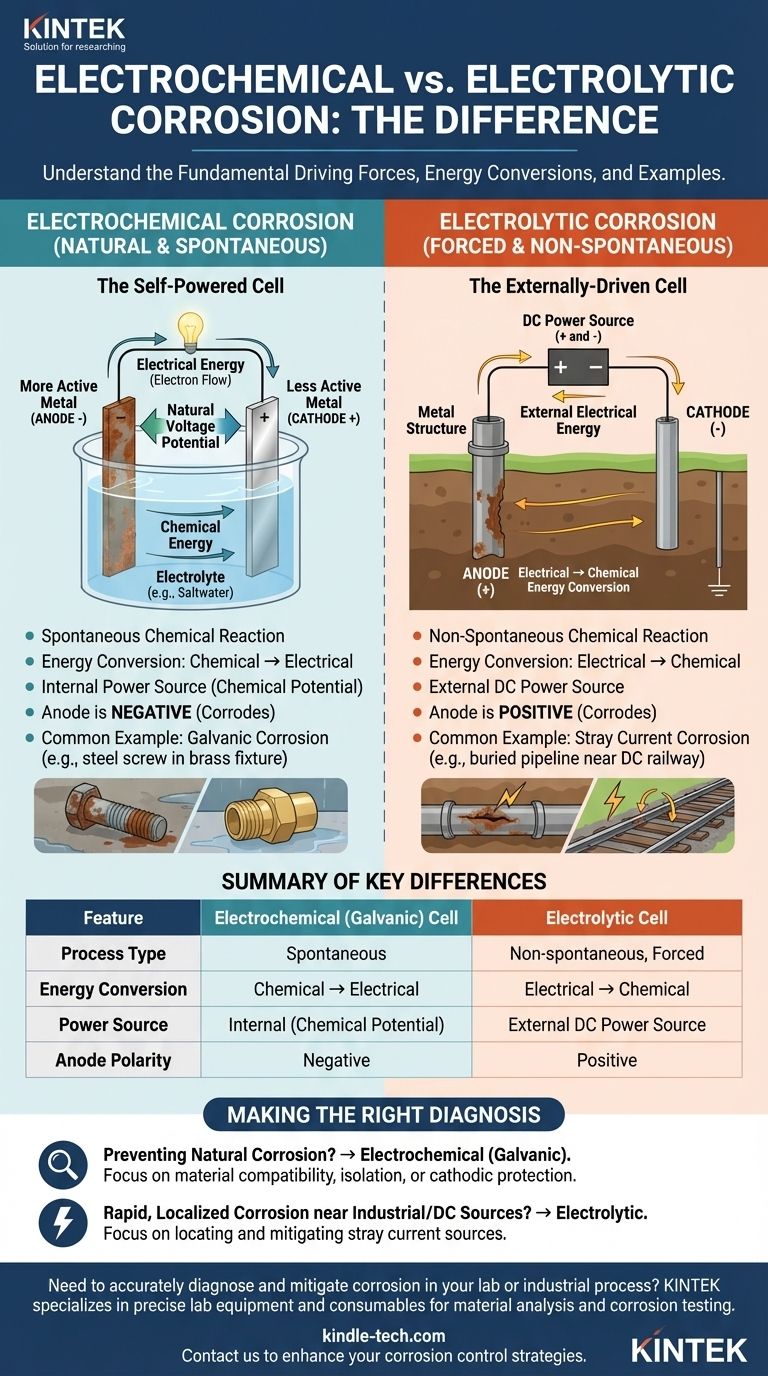
A livello fondamentale, la differenza tra una cella di corrosione elettrolitica e una elettrochimica risiede nella loro conversione energetica e nella forza motrice. Una cella elettrochimica è un processo spontaneo che converte l'energia chimica immagazzinata in energia elettrica, causando corrosione naturale. Al contrario, una cella elettrolitica è un processo non spontaneo che utilizza energia elettrica esterna per forzare una reazione chimica, causando corrosione indotta.
La distinzione fondamentale è la spontaneità. La corrosione elettrochimica avviene naturalmente da sola, come una batteria che si scarica. La corrosione elettrolitica è imposta a un materiale da una fonte di alimentazione esterna, come la corrente continua vagante da un sistema ferroviario.

La Cella Elettrochimica: Lo Stato Naturale della Corrosione
Una cella elettrochimica, spesso chiamata cella galvanica, è il meccanismo alla base delle forme più comuni di corrosione. È un processo autonomo e naturale.
Una Reazione Chimica Spontanea
Questo tipo di cella si forma quando due metalli diversi sono in contatto elettrico in presenza di un elettrolita (come acqua salata). Tra di essi esiste un potenziale di tensione naturale.
Il metallo più chimicamente attivo diventa l'anodo (elettrodo negativo) e si corrode, rilasciando elettroni. Il metallo meno attivo diventa il catodo (elettrodo positivo) e accetta questi elettroni.
Conversione di Energia: Da Chimica a Elettrica
La forza motrice è il rilascio di energia chimica immagazzinata all'interno del metallo più attivo. Questa energia chimica viene convertita direttamente in energia elettrica sotto forma di flusso di elettroni dall'anodo al catodo. Questo processo non richiede alimentazione esterna.
Un esempio classico è la corrosione galvanica, dove una vite d'acciaio (anodo) arrugginisce rapidamente se collegata a un raccordo in ottone (catodo) in un ambiente umido.
La Cella Elettrolitica: Corrosione Forzata
Una cella elettrolitica innesca una reazione chimica che normalmente non si verificherebbe. Lo fa applicando una fonte esterna di energia elettrica.
Una Reazione Chimica Non Spontanea
Questo processo supera le tendenze naturali dei materiali coinvolti. La fonte di alimentazione esterna costringe un metallo a diventare un anodo e a corrodersi, anche se altrimenti sarebbe stabile.
La corrosione si verifica dove questa corrente continua (DC) fornita esternamente lascia la struttura metallica per entrare in un elettrolita.
Conversione di Energia: Da Elettrica a Chimica
Qui, l'energia elettrica da una fonte esterna viene convertita in energia chimica, che si manifesta come reazione di corrosione. La cella consuma energia per funzionare.
Uno scenario comune nel mondo reale è la corrosione da corrente vagante. Una tubazione interrata che corre vicino a una ferrovia alimentata a corrente continua può raccogliere corrente dispersa, costringendo la sezione del tubo dove la corrente esce verso il terreno a corrodersi a una velocità accelerata.
Comprendere le Differenze Chiave
Sebbene entrambi i processi coinvolgano anodi, catodi e un elettrolita, le loro caratteristiche fondamentali sono opposte. Riconoscere queste differenze è fondamentale per una diagnosi e una mitigazione appropriate.
Forza Motrice e Fonte di Alimentazione
La distinzione più importante è la forza motrice. Una cella elettrochimica è autoalimentata dalla differenza di potenziale chimico tra i materiali. Una cella elettrolitica è alimentata esternamente da una fonte di corrente continua esterna.
Polarità degli Elettrodi
La polarità dell'anodo e del catodo è invertita tra le due celle, un frequente punto di confusione.
- In una cella elettrochimica (galvanica), l'anodo (dove avviene la corrosione) è negativo e il catodo è positivo.
- In una cella elettrolitica, la fonte di alimentazione esterna rende l'anodo (dove avviene la corrosione) positivo e il catodo è negativo.
Implicazioni Pratiche
L'errata identificazione del tipo di cella di corrosione porta a soluzioni errate. Ad esempio, cambiare le coppie di materiali potrebbe risolvere un problema di corrosione galvanica ma non farà nulla per fermare la corrosione da corrente vagante.
Fare la Diagnosi Giusta
Comprendere il meccanismo sottostante è il primo passo verso un efficace controllo della corrosione. Il vostro approccio diagnostico dovrebbe essere guidato dal tipo di cella sospettato.
- Se il vostro obiettivo principale è prevenire la corrosione naturale: Probabilmente avete a che fare con una cella elettrochimica (galvanica). La vostra soluzione comporta la selezione di materiali compatibili, il loro isolamento elettrico o l'applicazione di protezione catodica.
- Se state indagando su una corrosione rapida e localizzata vicino ad attrezzature industriali o transito DC: Siete quasi certamente di fronte a una cella elettrolitica. La vostra priorità deve essere quella di localizzare e mitigare la fonte della corrente vagante esterna.
In definitiva, sapere se la corrosione sta avvenendo naturalmente o è forzata da un'influenza esterna determina l'intera strategia di prevenzione e controllo.
Tabella riassuntiva:
| Caratteristica | Cella Elettrochimica (Galvanica) | Cella Elettrolitica |
|---|---|---|
| Tipo di Processo | Spontaneo | Non spontaneo, Forzato |
| Conversione di Energia | Chimica → Elettrica | Elettrica → Chimica |
| Fonte di Alimentazione | Interna (Potenziale Chimico) | Fonte di Alimentazione DC Esterna |
| Polarità dell'Anodo | Negativa | Positiva |
| Esempio Comune | Corrosione Galvanica (es. acciaio/ottone) | Corrosione da Corrente Vagante (es. da ferrovie) |
Hai bisogno di diagnosticare e mitigare con precisione la corrosione nel tuo laboratorio o processo industriale?
Comprendere l'esatto tipo di cella di corrosione è il primo passo verso una soluzione efficace. Gli esperti di KINTEK sono specializzati nella fornitura delle precise attrezzature da laboratorio e dei materiali di consumo necessari per l'analisi dei materiali e i test di corrosione. Che tu stia indagando su reazioni galvaniche o effetti di corrente vagante, abbiamo gli strumenti per supportare la tua ricerca e garantire l'integrità dei materiali.
Contattaci oggi stesso tramite il nostro modulo di contatto per discutere le tue specifiche esigenze di laboratorio e scoprire come le soluzioni KINTEK possono migliorare le tue strategie di controllo della corrosione.
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrochimica per Corrosione Piatta
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrolitica in PTFE Cella Elettrochimica Resistente alla Corrosione Sigillata e Non Sigillata
Domande frequenti
- Come fa un sistema di celle elettrochimiche a garantire la precisione della misurazione durante il test di riattivazione potenziocinetica a doppio anello (DL-EPR) dell'acciaio inossidabile super duplex?
- Qual è l'intervallo di volume della cella elettrolitica per la valutazione dei rivestimenti? Una guida alla scelta della dimensione giusta
- Qual è il principio di funzionamento di una cella elettrolitica per la corrosione a piastra piana? Una guida ai test sui materiali controllati
- Come funziona una cella elettrolitica a tre elettrodi? Test di precisione per acciaio 8620 in ambienti corrosivi
- Quali sono i vantaggi di una cella elettrochimica piana per la corrosione? Ottenere un'analisi precisa di vaiolatura e interstizi



















