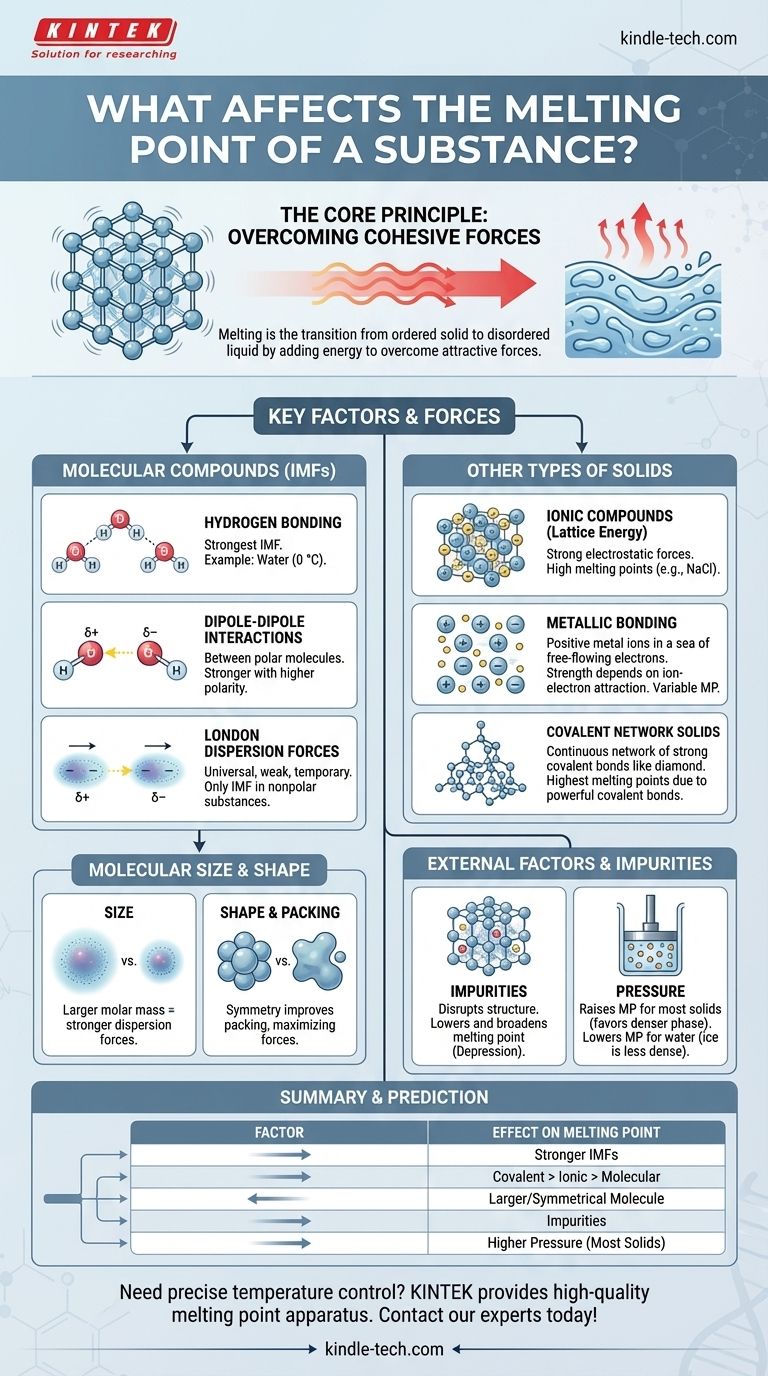
In sostanza, il punto di fusione di una sostanza è determinato dall'energia necessaria per superare le forze attrattive che tengono le sue particelle in una struttura fissa e tridimensionale. I fattori primari sono la forza di queste forze—che siano legami chimici o forze intermolecolari più deboli—e il modo in cui le particelle si impacchettano. Anche fattori come la dimensione molecolare, la forma e la presenza di impurità giocano un ruolo cruciale.
Il principio centrale è semplice: forze attrattive più forti tra le particelle richiedono più energia termica per essere spezzate, risultando in un punto di fusione più alto. L'intera storia dei punti di fusione è un'esplorazione di ciò che crea e modifica queste forze.

Il Principio Fondamentale: Superare le Forze Coesive
La fusione è una trasformazione fisica da uno stato solido ordinato a uno stato liquido disordinato. Comprendere questa transizione è fondamentale per capire i fattori che la controllano.
Cos'è la Fusione?
In un solido, atomi, ioni o molecole sono bloccati in una disposizione fissa chiamata reticolo cristallino. Vibrano sul posto ma non si muovono l'uno rispetto all'altro.
La fusione avviene alla temperatura specifica in cui queste particelle acquisiscono sufficiente energia cinetica dal calore per liberarsi dalle loro posizioni fisse e iniziare a fluire.
Energia vs. Coesione
Il calore che si aggiunge a una sostanza aumenta l'energia cinetica delle sue particelle, facendole vibrare più intensamente. Il punto di fusione è la temperatura di equilibrio in cui questa energia vibrazionale diventa abbastanza potente da superare le forze coesive che tengono insieme il reticolo.
Fattori Chiave per i Composti Molecolari
Per le sostanze costituite da molecole discrete (come acqua, cera o zucchero), le forze tra le molecole—non i legami al loro interno—sono ciò che si rompe durante la fusione. Queste sono chiamate forze intermolecolari (IMFs).
Legame Idrogeno: La IMF più Forte
Un legame idrogeno è un potente tipo di interazione dipolo-dipolo che si verifica quando l'idrogeno è legato a un atomo altamente elettronegativo come azoto (N), ossigeno (O) o fluoro (F).
L'acqua (H₂O) è un classico esempio. Il suo alto punto di fusione (0 °C) rispetto a molecole di dimensioni simili è dovuto interamente alla forte rete di legami idrogeno che tengono insieme le molecole nel ghiaccio.
Interazioni Dipolo-Dipolo
Queste forze esistono tra molecole polari, che hanno estremità parzialmente positive e parzialmente negative permanenti. L'estremità positiva di una molecola attrae l'estremità negativa della sua vicina.
Maggiore è la polarità della molecola, più forte è l'attrazione dipolo-dipolo e più alto è il punto di fusione.
Forze di Dispersione di London: La Forza Universale
Queste attrazioni temporanee e deboli esistono in tutte le molecole, sia polari che non polari. Derivano da fluttuazioni momentanee nella nuvola elettronica attorno a una molecola, creando dipoli fugaci.
Per le sostanze non polari come il metano (CH₄) o l'ottano (C₈H₁₈), le forze di dispersione di London sono le uniche IMF presenti.
Il Ruolo della Dimensione e della Forma Molecolare
Dimensione (Massa Molare): Molecole più grandi hanno nuvole elettroniche più grandi, che sono più facilmente distorte. Ciò porta a forze di dispersione di London più forti e, di conseguenza, a punti di fusione più alti. Questo è il motivo per cui gli idrocarburi grandi e cerosi sono solidi a temperatura ambiente, mentre quelli piccoli come il metano sono gas.
Simmetria e Impacchettamento: Le molecole simmetriche e compatte possono impacchettarsi in modo più stretto ed efficiente in un reticolo cristallino. Questo impacchettamento ravvicinato massimizza l'efficacia delle forze intermolecolari, portando a un punto di fusione più alto rispetto agli isomeri di forma irregolare della stessa dimensione.
Oltre le Molecole: Altri Tipi di Solidi
Non tutti i solidi sono costituiti da molecole discrete. In molti materiali, la fusione richiede la rottura di potenti legami chimici che si estendono attraverso l'intera struttura.
Composti Ionici ed Energia Reticolare
Nei composti ionici come il sale da cucina (NaCl), ioni positivi e negativi sono tenuti in un reticolo rigido da forti forze elettrostatiche (legami ionici). La fusione di queste sostanze richiede il superamento di questa immensa attrazione, che è misurata dall'energia reticolare.
Poiché i legami ionici sono molto più forti delle forze intermolecolari, i composti ionici hanno punti di fusione molto alti.
Metalli e Legame Metallico
I metalli sono tenuti insieme da legami metallici, dove un "mare" di elettroni delocalizzati scorre liberamente tra un reticolo fisso di ioni metallici positivi.
La forza dell'attrazione tra gli ioni e questo mare di elettroni determina il punto di fusione. Metalli come il tungsteno e il titanio formano legami metallici molto forti e hanno punti di fusione eccezionalmente alti.
Solidi a Rete Covalente
In questi materiali, gli atomi sono uniti da una rete continua di forti legami covalenti. Non ci sono molecole individuali.
Per fondere un solido a rete covalente come il diamante (carbonio) o il quarzo (biossido di silicio), è necessario rompere questi potenti legami covalenti. Ciò richiede un'enorme quantità di energia, conferendo loro i punti di fusione più alti di qualsiasi classe di sostanza.
Comprendere i Compromessi e i Fattori Esterni
Le proprietà intrinseche di una sostanza non sono l'unica influenza. Anche le condizioni esterne e la composizione hanno un impatto significativo.
L'Effetto delle Impurità: Depressione del Punto di Fusione
La presenza di un'impurità interrompe la struttura uniforme di un reticolo cristallino. Questo reticolo indebolito e disorganizzato richiede meno energia per rompersi.
Questo fenomeno è noto come depressione del punto di fusione. È il motivo per cui una sostanza pura ha un punto di fusione netto e distinto, mentre una sostanza impura fonde in un intervallo di temperatura ampio e più basso. È anche il principio alla base dell'uso del sale per sciogliere il ghiaccio sulle strade invernali.
L'Influenza della Pressione
Per la maggior parte delle sostanze, la fase solida è più densa della fase liquida. L'aumento della pressione favorisce lo stato più denso, avvicinando le particelle e rendendo più difficile per loro liberarsi. Pertanto, per la maggior parte dei materiali, una pressione più alta aumenta il punto di fusione.
L'acqua è una famosa eccezione. Poiché il ghiaccio è meno denso dell'acqua liquida, l'aumento della pressione favorisce lo stato liquido, abbassando così il punto di fusione.
Come Prevedere i Punti di Fusione Relativi
Usa questi principi per confrontare diverse sostanze e prevederne il comportamento.
- Se stai confrontando un composto a rete covalente, ionico e molecolare: Il composto a rete covalente (es. diamante) sarà il più alto, seguito dal composto ionico (es. sale), con il composto molecolare (es. zucchero) molto più basso.
- Se stai confrontando composti molecolari: Per prima cosa, controlla la presenza di legami idrogeno, che è un fattore dominante. Se assenti, confronta la polarità. Se sono tutti non polari o hanno polarità simile, quello con la massa molare maggiore avrà generalmente il punto di fusione più alto.
- Se stai confrontando composti ionici: Il composto con le cariche più alte sui suoi ioni e/o raggi ionici più piccoli avrà un'energia reticolare più forte e un punto di fusione più alto.
- Se devi valutare la purezza: Una sostanza che fonde nettamente al suo punto di fusione noto è probabilmente pura, mentre una che fonde gradualmente in un intervallo al di sotto del suo punto previsto è impura.
Comprendendo queste forze fondamentali, puoi prevedere efficacemente come la struttura microscopica di una sostanza ne determina il comportamento di fusione.
Tabella Riepilogativa:
| Fattore | Effetto sul Punto di Fusione | Principio Chiave |
|---|---|---|
| Forze Intermolecolari (IMFs) | Più alto con IMFs più forti | Legame idrogeno > dipolo-dipolo > dispersione di London |
| Tipo di Legame Chimico | Rete covalente > Ionico > Metallico > Molecolare | Forza dei legami che devono essere rotti |
| Dimensione/Forma Molecolare | Più alto con massa molare maggiore e forma simmetrica | Aumenta le forze di London e migliora l'impacchettamento del reticolo |
| Impurità | Abbassa (Depressione del Punto di Fusione) | Disturba il reticolo cristallino, richiedendo meno energia per fondere |
| Pressione | Aumenta (per la maggior parte dei solidi); Abbassa (per ghiaccio/acqua) | Favorisce la fase più densa (solido per la maggior parte, liquido per l'acqua) |
Hai bisogno di un controllo preciso della temperatura per la tua analisi dei materiali? Comprendere i punti di fusione è fondamentale per la caratterizzazione dei materiali, la valutazione della purezza e lo sviluppo dei processi. KINTEK è specializzata nella fornitura di attrezzature da laboratorio di alta qualità, inclusi apparecchi per la determinazione del punto di fusione e forni, per aiutare il tuo laboratorio a ottenere risultati accurati e affidabili. Contatta i nostri esperti oggi stesso per trovare la soluzione perfetta per la tua specifica applicazione!
Guida Visiva
Prodotti correlati
- Fornace a muffola con sollevamento inferiore per laboratorio
- Fornace a muffola da 1800℃ per laboratorio
- Fornace a muffola da 1400℃ per laboratorio
- Fornace a muffola da 1700℃ per laboratorio
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Qual è la temperatura di un forno? Dipende dal materiale e dall'obiettivo del processo
- A quale temperatura è sicuro aprire un forno a muffola? Una guida per prevenire lesioni e danni alle apparecchiature
- Quali sono i materiali utilizzati in un forno a muffola? Una guida per una costruzione durevole e prestazioni ottimali
- Qual è la temperatura di esercizio di un forno a muffola? Ottieni un controllo preciso del calore per il tuo laboratorio
- A cosa serve un forno a muffola? Ottenere una lavorazione pura ad alta temperatura



















