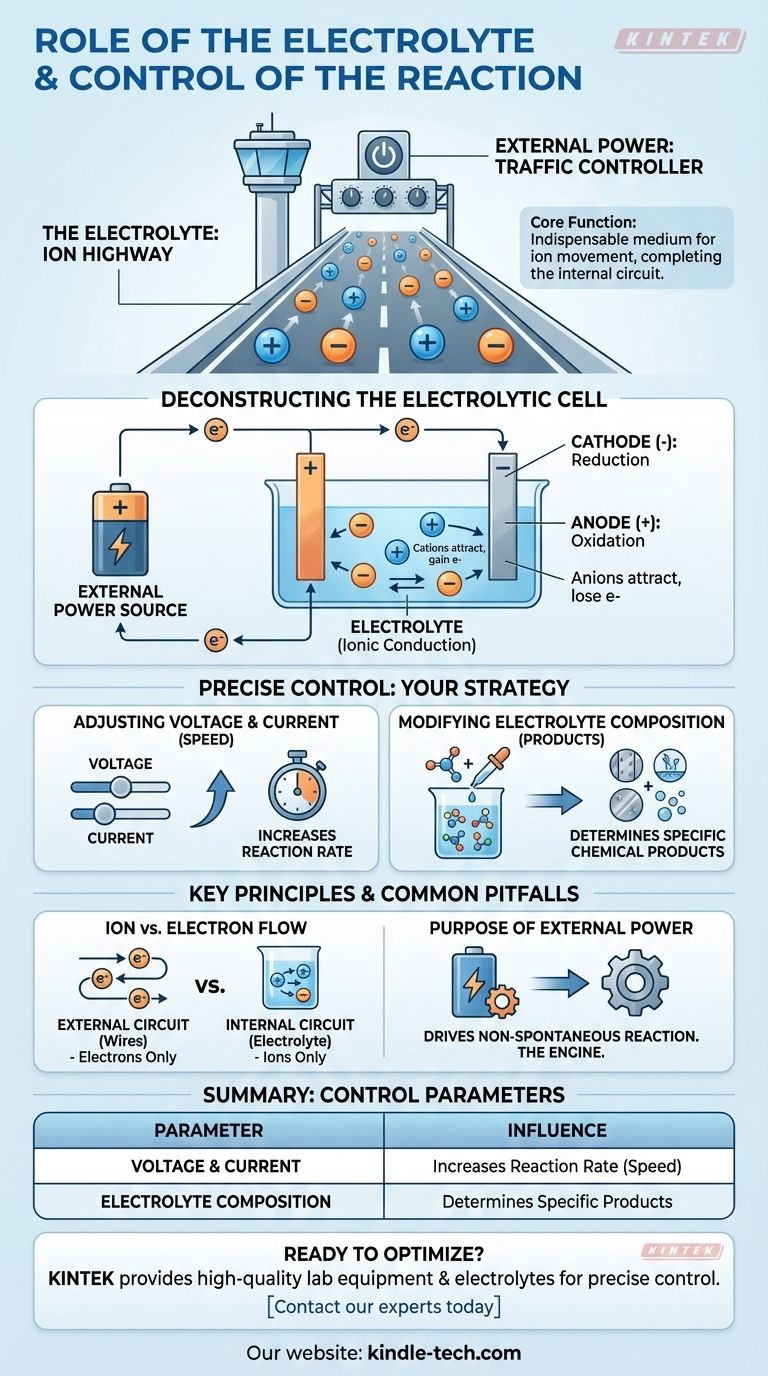
In sostanza, l'elettrolita è il mezzo indispensabile per il movimento degli ioni all'interno di una cella, completando il circuito elettrico che consente il verificarsi di una reazione chimica. La reazione stessa è controllata con precisione manipolando gli input elettrici esterni, in particolare la tensione e la corrente, e modificando la composizione chimica della soluzione elettrolitica.
L'elettrolita agisce come un'"autostrada ionica", consentendo alle particelle cariche di viaggiare tra gli elettrodi all'interno della cella. L'alimentatore esterno agisce come il "controllore del traffico", dettando la velocità e la direzione della reazione chimica gestendo il flusso di elettroni.

Il Ruolo Fondamentale dell'Elettrolita
Una reazione elettrochimica richiede un circuito completo. L'elettrolita è responsabile della metà interna di tale circuito, un ruolo fondamentalmente diverso dai fili collegati esternamente.
Cos'è un Elettrolita?
Un elettrolita è una soluzione, tipicamente acquosa o organica, che contiene ioni dissociati.
Questi ioni positivi e negativi liberi sono ciò che rende la soluzione elettricamente conduttiva.
Abilitare la Conduzione Ionica
La funzione principale dell'elettrolita è la conduzione ionica.
Mentre gli elettroni fluiscono attraverso i fili esterni, gli ioni devono fluire attraverso la soluzione tra i due elettrodi. Questo movimento di ioni carichi completa il circuito, consentendo alla reazione di essere sostenuta.
Scomposizione della Cella Elettrolitica
In una cella elettrolitica, una fonte di alimentazione esterna guida una reazione chimica che altrimenti non avverrebbe da sola. Ecco come i componenti lavorano insieme.
La Fonte di Alimentazione Esterna
Il processo inizia con una fonte di alimentazione esterna, come una batteria o un alimentatore.
Questa fonte pompa attivamente elettroni, creando una differenza di carica tra i due elettrodi che costringe la reazione a procedere.
Il Catodo (Sito di Riduzione)
La fonte esterna spinge gli elettroni verso il catodo, conferendogli una carica negativa.
Questa carica negativa attrae gli ioni caricati positivamente (cationi) dall'elettrolita. Quando questi ioni raggiungono il catodo, acquistano elettroni in un processo chiamato riduzione.
L'Anodo (Sito di Ossidazione)
Contemporaneamente, la fonte esterna sottrae elettroni dall'anodo, conferendogli una carica positiva.
Questa carica positiva attrae gli ioni caricati negativamente (anioni) dall'elettrolita. All'anodo, questi ioni perdono elettroni in un processo noto come ossidazione.
Come Viene Controllata con Precisione la Reazione
Hai il controllo diretto sull'esito e sulla velocità della reazione elettrochimica regolando tre parametri chiave.
Regolazione di Tensione e Corrente
La tensione può essere considerata la "pressione" elettrica che guida la reazione, mentre la corrente è la velocità del flusso di elettroni.
Aumentare la tensione e la corrente generalmente aumenterà la velocità con cui si verifica la reazione chimica. Ciò ti offre un controllo diretto e in tempo reale sulla velocità del processo.
Modifica della Composizione dell'Elettrolita
La specifica reazione chimica che avviene è determinata dagli ioni disponibili nell'elettrolita.
Modificando la composizione dell'elettrolita, ad esempio utilizzando un sale o un solvente diverso, è possibile modificare i prodotti che si formano all'anodo e al catodo.
Errori Comuni e Principi Chiave
Per comprendere veramente il sistema, è fondamentale distinguere tra le due metà del circuito e la natura della cella.
Movimento Ionico vs. Flusso di Elettroni
Un punto di confusione comune è la differenza tra ciò che accade all'interno e all'esterno della cella.
Gli elettroni fluiscono solo attraverso il circuito esterno (i fili). Gli ioni fluiscono solo attraverso il circuito interno (l'elettrolita). La reazione sulle superfici degli elettrodi è ciò che collega questi due percorsi distinti.
Lo Scopo dell'Alimentazione Esterna
È fondamentale ricordare che questo processo descrive una cella elettrolitica.
In queste celle, l'energia elettrica viene utilizzata per guidare una reazione chimica non spontanea. La fonte di alimentazione esterna non è facoltativa; è il motore che rende possibile l'intero processo.
Fare la Scelta Giusta per il Tuo Obiettivo
La tua strategia di controllo dipende interamente da ciò che vuoi ottenere con la reazione.
- Se il tuo obiettivo principale è accelerare la velocità di reazione: Aumenta la tensione e la corrente applicate per guidare il flusso di elettroni e ioni più rapidamente.
- Se il tuo obiettivo principale è creare un prodotto chimico specifico: Seleziona e controlla attentamente la composizione dell'elettrolita per garantire che gli ioni desiderati siano disponibili per la reazione.
- Se il tuo obiettivo principale è comprendere l'efficienza del sistema: Devi monitorare sia il flusso di elettroni (corrente) nel circuito esterno sia il cambiamento chimico risultante (conversione ionica) agli elettrodi.
In definitiva, padroneggiare un processo elettrochimico significa capire che l'elettrolita e il circuito esterno sono due metà di un unico sistema controllabile.
Tabella Riassuntiva:
| Parametro di Controllo | Come Influenza la Reazione |
|---|---|
| Tensione e Corrente | Aumenta la velocità (rapidità) della reazione chimica. |
| Composizione dell'Elettrolita | Determina i prodotti chimici specifici che si formano. |
Pronto a Ottimizzare il Tuo Processo Elettrochimico?
Che tu stia sviluppando nuovi materiali, eseguendo galvanoplastica o conducendo test analitici precisi, controllare la tua reazione elettrochimica è fondamentale. KINTEK è specializzata nella fornitura di apparecchiature di laboratorio e materiali di consumo di alta qualità per tutte le tue esigenze di laboratorio, inclusi alimentatori affidabili ed elettroliti puri.
Contatta oggi i nostri esperti per discutere come possiamo aiutarti a ottenere un controllo preciso e risultati superiori nel tuo laboratorio.
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Bagno d'acqua a doppio strato a cinque porte Cella elettrolitica elettrochimica
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
Domande frequenti
- Qual è la struttura di una cella elettrolitica a membrana scambiabile di tipo H? Una guida alla separazione elettrochimica precisa
- Cos'è una cella di tipo H? Una guida alle celle elettrochimiche divise per esperimenti accurati
- Quali caratteristiche ottiche presenta la cella elettrolitica di tipo H? Finestrini di quarzo di precisione per la fotoelettrochimica
- Come deve essere conservata la cella elettrolitica di tipo H quando non è in uso? Guida esperta per la conservazione e la manutenzione
- Quali sono le specifiche standard di apertura per una cella elettrolitica a membrana scambiabile di tipo H? Porte asimmetriche per un'elettrochimica precisa



















