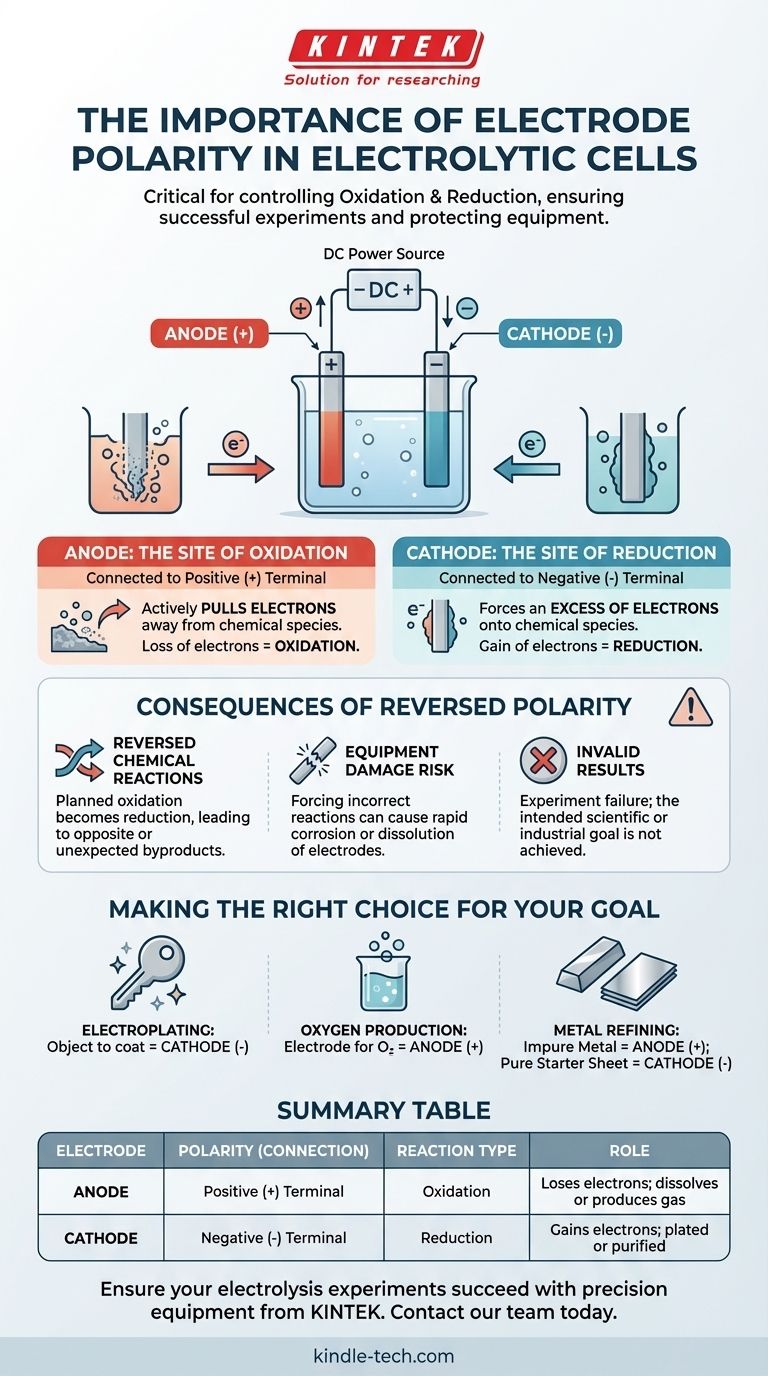
In una cella elettrolitica, la corretta polarità degli elettrodi è fondamentale perché detta dove avvengono le reazioni chimiche fondamentali di ossidazione e riduzione. Il terminale positivo della sorgente di alimentazione definisce l'anodo (il sito dell'ossidazione) e il terminale negativo definisce il catodo (il sito della riduzione). Invertire questi collegamenti invertirà la trasformazione chimica prevista, portando a un fallimento sperimentale e a potenziali danni alle apparecchiature.
Il principio fondamentale è questo: la polarità dell'elettrodo non è un'etichetta arbitraria, ma il meccanismo di controllo diretto della tua reazione chimica. Determina quale elettrodo perde elettroni (ossidazione) e quale li acquista (riduzione), controllando così quali sostanze vengono formate o consumate.

I Ruoli Fondamentali di Anodo e Catodo
Per comprendere l'importanza della polarità, dobbiamo prima definire i ruoli dei due elettrodi nel processo elettrolitico. Questi ruoli sono guidati interamente dal loro collegamento a una fonte di alimentazione esterna.
L'Anodo: Il Sito dell'Ossidazione
L'anodo è l'elettrodo collegato al terminale positivo (+) dell'alimentatore.
Questo collegamento positivo attira attivamente gli elettroni dalle specie chimiche nella soluzione elettrolitica che si trovano vicino alla superficie dell'anodo. Questa perdita forzata di elettroni è chiamata ossidazione.
Il Catodo: Il Sito della Riduzione
Il catodo è l'elettrodo collegato al terminale negativo (-) dell'alimentatore.
Questo collegamento negativo crea un eccesso di elettroni sulla superficie del catodo. Questi elettroni vengono quindi forzati sulle specie chimiche nella soluzione, facendole acquistare elettroni. Questo processo è chiamato riduzione.
L'Alimentatore: La Forza Motrice
A differenza di una batteria standard (una cella galvanica) che produce energia da una reazione spontanea, una cella elettrolitica utilizza energia per guidare una reazione non spontanea.
L'alimentatore esterno agisce come una pompa per gli elettroni. Li estrae dall'anodo e li spinge verso il catodo, forzando un cambiamento chimico che non avverrebbe da solo.
Comprendere le Conseguenze dell'Inversione di Polarità
Collegare gli elettrodi ai terminali sbagliati non è un errore minore; altera fondamentalmente l'intero esperimento. Questo è spesso definito "inversione della polarità".
Inverti le Reazioni Chimiche
Se inverti i collegamenti, l'elettrodo che intendevi fosse l'anodo diventa il catodo, e viceversa.
La reazione chimica che avevi previsto per l'anodo (ossidazione) non avverrà. Invece, avverrà lì una reazione di riduzione. Ciò significa che il tuo esperimento produrrà l'opposto dei risultati previsti o creerà sottoprodotti del tutto inaspettati.
Rischio di Danneggiare le Tue Apparecchiature
Forzare una reazione su un materiale sbagliato può avere conseguenze distruttive. Ad esempio, se stai galvanizzando, invertire la polarità inizierà a dissolvere l'oggetto che intendevi rivestire.
In alcuni casi, tentare di ossidare un elettrodo non progettato per questo può causarne una rapida corrosione. Ciò può contaminare la tua soluzione e danneggiare permanentemente l'elettrodo.
I Tuoi Risultati Non Saranno Validi
In definitiva, l'inversione della polarità invalida l'esperimento. Se stai cercando di depositare uno strato di rame su una chiave, invertire l'allestimento farà sì che la fonte di rame venga placcata con il metallo della chiave, dissolvendo di fatto la chiave. Il risultato è l'incapacità di raggiungere l'obiettivo scientifico o industriale.
Fare la Scelta Giusta per il Tuo Obiettivo
Assegnare correttamente la polarità è il modo in cui comandi il risultato chimico. Prima di collegare la tua fonte di alimentazione, conferma quale elettrodo deve essere l'anodo (+) e quale deve essere il catodo (-).
- Se il tuo obiettivo principale è la galvanizzazione di un oggetto: L'oggetto che vuoi rivestire deve essere il catodo (-), poiché è qui che gli ioni metallici positivi verranno ridotti in uno strato metallico solido.
- Se il tuo obiettivo principale è produrre gas ossigeno dall'acqua: L'elettrodo dove vuoi che si formi l'ossigeno deve essere l'anodo (+), poiché è qui che le molecole d'acqua vengono ossidate.
- Se il tuo obiettivo principale è raffinare metallo impuro: Il blocco di metallo impuro deve essere l'anodo (+) in modo che possa essere ossidato e dissolto nella soluzione, mentre un foglio di partenza puro deve essere il catodo (-) per raccogliere il metallo appena purificato.
Padroneggiare la polarità degli elettrodi ti dà il controllo diretto sulle reazioni elettrochimiche che desideri eseguire.
Tabella Riassuntiva:
| Elettrodo | Polarità (Collegamento) | Tipo di Reazione | Ruolo |
|---|---|---|---|
| Anodo | Terminale Positivo (+) | Ossidazione | Perde elettroni; il bersaglio si dissolve o produce gas (es. O₂) |
| Catodo | Terminale Negativo (-) | Riduzione | Acquisisce elettroni; il bersaglio viene placcato o purificato |
Assicurati che i tuoi esperimenti di elettrolisi abbiano successo con apparecchiature di precisione KINTEK.
Che tu stia raffinando metalli, galvanizzando o conducendo ricerche, le nostre apparecchiature e i nostri materiali di consumo specializzati sono progettati per accuratezza e durata. I nostri esperti possono aiutarti a selezionare gli alimentatori e gli elettrodi giusti per controllare perfettamente le tue reazioni chimiche.
Non rischiare risultati non validi o apparecchiature danneggiate: contatta oggi il nostro team per discutere le tue specifiche esigenze di laboratorio.
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Celle Elettrolitiche PEM Personalizzabili per Diverse Applicazioni di Ricerca
- Cella a Flusso Personalizzabile per la Riduzione di CO2 per Ricerca su NRR, ORR e CO2RR
Domande frequenti
- Qual è la procedura corretta per la pulizia post-esperimento e la conservazione di una cella elettrolitica interamente in quarzo? Garantire longevità e riproducibilità
- Come si dovrebbe mantenere una cella elettrolitica interamente in quarzo e i suoi componenti per un uso a lungo termine? Una guida per massimizzare la durata dell'attrezzatura
- Quali sono le specifiche di apertura standard per celle elettrolitiche interamente in quarzo sigillate e non sigillate? Ottimizza la tua configurazione elettrochimica
- Perché viene utilizzata una cella elettrolitica al quarzo per le acque reflue dell'acido acrilico? Garantire la stabilità chimica e l'integrità dei dati
- Quali sono le procedure operative e le precauzioni di sicurezza durante un esperimento che utilizza una cella elettrolitica interamente in quarzo? Garantisci sicurezza e precisione nel tuo laboratorio



















