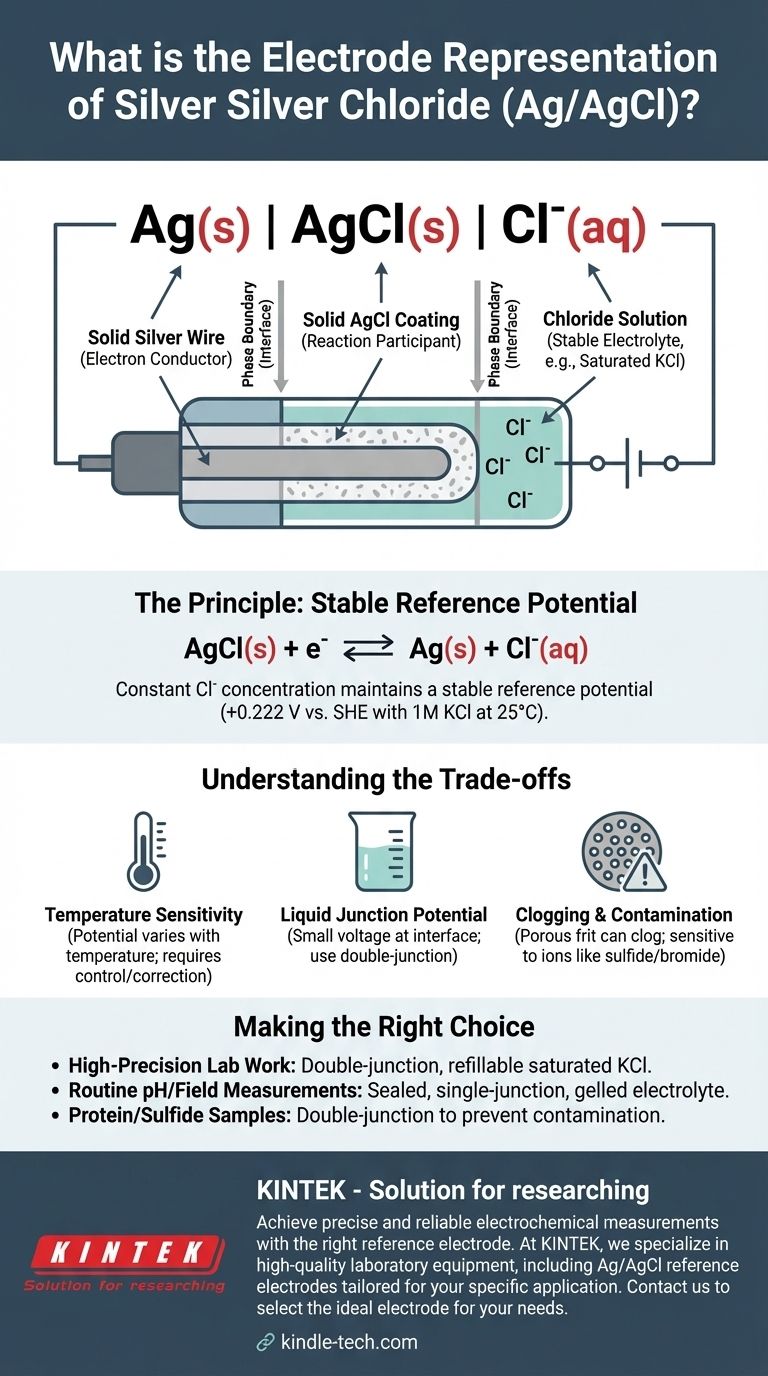
La rappresentazione abbreviata standard per un elettrodo argento-cloruro d'argento è Ag(s) | AgCl(s) | Cl⁻(aq). Questa notazione elettrochimica descrive le fasi fisiche e chimiche dell'elettrodo, dal filo di argento solido alla soluzione acquosa contenente ioni cloruro. Il potenziale specifico dell'elettrodo dipende criticamente dalla concentrazione di questi ioni cloruro.
Questa notazione è più di un'etichetta tecnica; è uno schema per uno degli elettrodi di riferimento più affidabili e comuni in elettrochimica. Descrive un sistema progettato per mantenere un potenziale costante e stabile, fornendo una base fissa rispetto alla quale i potenziali di altri elettrodi possono essere misurati con precisione.

Decostruire la notazione dell'elettrodo
La rappresentazione Ag(s) | AgCl(s) | Cl⁻(aq) descrive in dettaglio la struttura dell'elettrodo dall'interno verso l'esterno. Ogni componente e simbolo ha un significato preciso.
La fase solida: Ag(s)
Questo rappresenta un filo d'argento solido. Questo filo funge da conduttore di elettroni, collegando l'elettrodo al circuito di misurazione esterno (un voltmetro o un potenziostato).
Il confine di fase: |
La singola barra verticale | indica un confine di fase. Indica l'interfaccia dove si incontrano due stati fisici diversi, in questo caso, il metallo d'argento solido e lo strato di cloruro d'argento solido.
Lo strato di sale insolubile: AgCl(s)
Questo denota uno strato di cloruro d'argento solido, scarsamente solubile, che è rivestito direttamente sulla superficie del filo d'argento. Questo strato è il cuore della funzione dell'elettrodo, partecipando direttamente alla reazione elettrochimica.
Il secondo confine di fase: |
Una seconda barra verticale segna il confine tra il rivestimento di cloruro d'argento solido e la soluzione elettrolitica acquosa circostante.
La soluzione elettrolitica: Cl⁻(aq)
Questo rappresenta la soluzione acquosa in cui è immerso il filo rivestito. Questa soluzione deve contenere una concentrazione nota e costante di ioni cloruro (Cl⁻). Tipicamente, viene utilizzata una soluzione di cloruro di potassio (KCl), spesso a una concentrazione specifica come 1 M o, più comunemente, una soluzione satura.
Il principio di un elettrodo di riferimento
L'elettrodo Ag/AgCl è apprezzato non per la sua reazione, ma per la sua stabilità. Fornisce una tensione costante che agisce come un punto zero affidabile per altre misurazioni.
La reazione dominante
Il potenziale stabile è stabilito da un equilibrio reversibile tra i componenti solidi e gli ioni cloruro nella soluzione. La semireazione è:
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
Finché la concentrazione (più precisamente, l'attività) degli ioni cloruro nella soluzione rimane costante, il potenziale di questa semicella non cambierà.
L'importanza della concentrazione costante di cloruro
L'uso di una soluzione satura di KCl assicura che la concentrazione di Cl⁻ sia costante e riproducibile. Se un po' d'acqua evapora, altro sale KCl si dissolve semplicemente per mantenere la saturazione. Questo è il motivo per cui il potenziale di riferimento è così stabile. Per una soluzione di KCl 1M a 25°C (298 K), questo potenziale è +0,222 V rispetto all'elettrodo standard a idrogeno (SHE).
Comprendere i compromessi
Sebbene altamente affidabile, l'elettrodo Ag/AgCl non è privo di limitazioni che richiedono considerazione per lavori precisi.
Sensibilità alla temperatura
Il potenziale dell'elettrodo è una funzione della temperatura. Per misurazioni altamente accurate, la temperatura della cella deve essere controllata o i potenziali misurati devono essere corretti per le variazioni di temperatura.
Potenziale di giunzione liquida
Quando la soluzione di KCl dell'elettrodo entra in contatto con una soluzione campione diversa, un piccolo voltaggio noto come potenziale di giunzione liquida può svilupparsi all'interfaccia. Questo introduce un errore piccolo ma sistematico nella misurazione, che può essere minimizzato utilizzando un elettrodo a doppia giunzione.
Intasamento e contaminazione
La fritta porosa che consente il contatto elettrico tra la soluzione interna e il campione può intasarsi. Può anche essere contaminata da ioni nel campione (come solfuro, bromuro o ioduro) che possono reagire con l'argento, causando la deriva del potenziale dell'elettrodo nel tempo.
Fare la scelta giusta per la tua misurazione
La tua applicazione determina quale configurazione dell'elettrodo è la migliore.
- Se il tuo obiettivo principale è il lavoro di laboratorio ad alta precisione: Usa un elettrodo Ag/AgCl a doppia giunzione con una soluzione di KCl satura ricaricabile per minimizzare il potenziale di giunzione e consentire una facile manutenzione.
- Se il tuo obiettivo principale sono le misurazioni di pH o sul campo di routine: Un elettrodo sigillato a giunzione singola con un elettrolita in gel è durevole, a bassa manutenzione e perfettamente adeguato.
- Se il tuo obiettivo principale è l'analisi di campioni contenenti proteine o solfuri: Devi usare un elettrodo a doppia giunzione per prevenire l'intasamento e la contaminazione della giunzione di riferimento primaria.
Comprendere questa notazione la trasforma da un'etichetta criptica in uno schema funzionale per misurazioni elettrochimiche affidabili.
Tabella riassuntiva:
| Componente | Simbolo | Descrizione |
|---|---|---|
| Filo d'argento solido | Ag(s) | Conduttore che si collega al circuito esterno. |
| Rivestimento di cloruro d'argento | AgCl(s) | Strato di sale insolubile che consente la reazione reversibile. |
| Soluzione di ioni cloruro | Cl⁻(aq) | Elettrolita acquoso (es. KCl) con concentrazione costante di Cl⁻. |
| Confine di fase |
Ottieni misurazioni elettrochimiche precise e affidabili con il giusto elettrodo di riferimento.
In KINTEK, siamo specializzati in attrezzature da laboratorio di alta qualità, inclusa una gamma di elettrodi di riferimento Ag/AgCl su misura per la tua specifica applicazione, sia che tu richieda modelli a doppia giunzione ad alta precisione per lavori di laboratorio sensibili o opzioni durevoli e a bassa manutenzione per analisi di routine.
I nostri esperti possono aiutarti a selezionare l'elettrodo ideale per garantire un potenziale stabile, minimizzare gli errori e migliorare la precisione della tua ricerca.
Contatta KINTEK oggi per discutere le tue esigenze di laboratorio e scoprire come i nostri materiali di consumo e attrezzature affidabili possono supportare il tuo lavoro.
Guida Visiva
Prodotti correlati
- Elettrodi di Riferimento Calomel Argento Cloruro Solfato di Mercurio per Uso di Laboratorio
- Elettrodo Elettrochimico a Disco Metallico
- Elettrodo a disco rotante in platino per applicazioni elettrochimiche
- Elettrodo a disco d'oro
- Elettrodo a disco rotante (anello-disco) RRDE / compatibile con PINE, ALS giapponese, Metrohm svizzero al carbonio vetroso platino
Domande frequenti
- Qual è il significato tecnico delle piastre di elettrodi paralleli nell'elettrocoagulazione? Ottimizzare l'efficienza del reattore
- Perché un elettrodo di grafite viene utilizzato come contro-elettrodo? Ottieni una riduzione elettrochimica pura con KINTEK
- Quali sono i vantaggi tecnici dell'utilizzo di un filo di platino a spirale come elettrodo ausiliario nei circuiti elettrochimici?
- Qual è il ruolo dell'elettrodo di Platino nei test sul Zircaloy-2? Garantire risultati elettrochimici di elevata purezza
- Perché l'elettrodo di riferimento gelificato Ag/AgCl è preferito per l'elettrolisi dell'acqua? Garantire alta stabilità e precisione
- Qual è la manutenzione raccomandata per la soluzione di riempimento di un elettrodo di riferimento? Una Guida per Letture Stabili e Accurate
- Quali ruoli svolgono gli elettrodi di platino e gli elettrodi Ag/AgCl nell'analisi dei rivestimenti? Garantire la precisione nei test
- Quale funzione svolge un catodo di acciaio inossidabile nel recupero dei PGM? Ruolo chiave nell'elettrodeposizione efficiente dei metalli



















