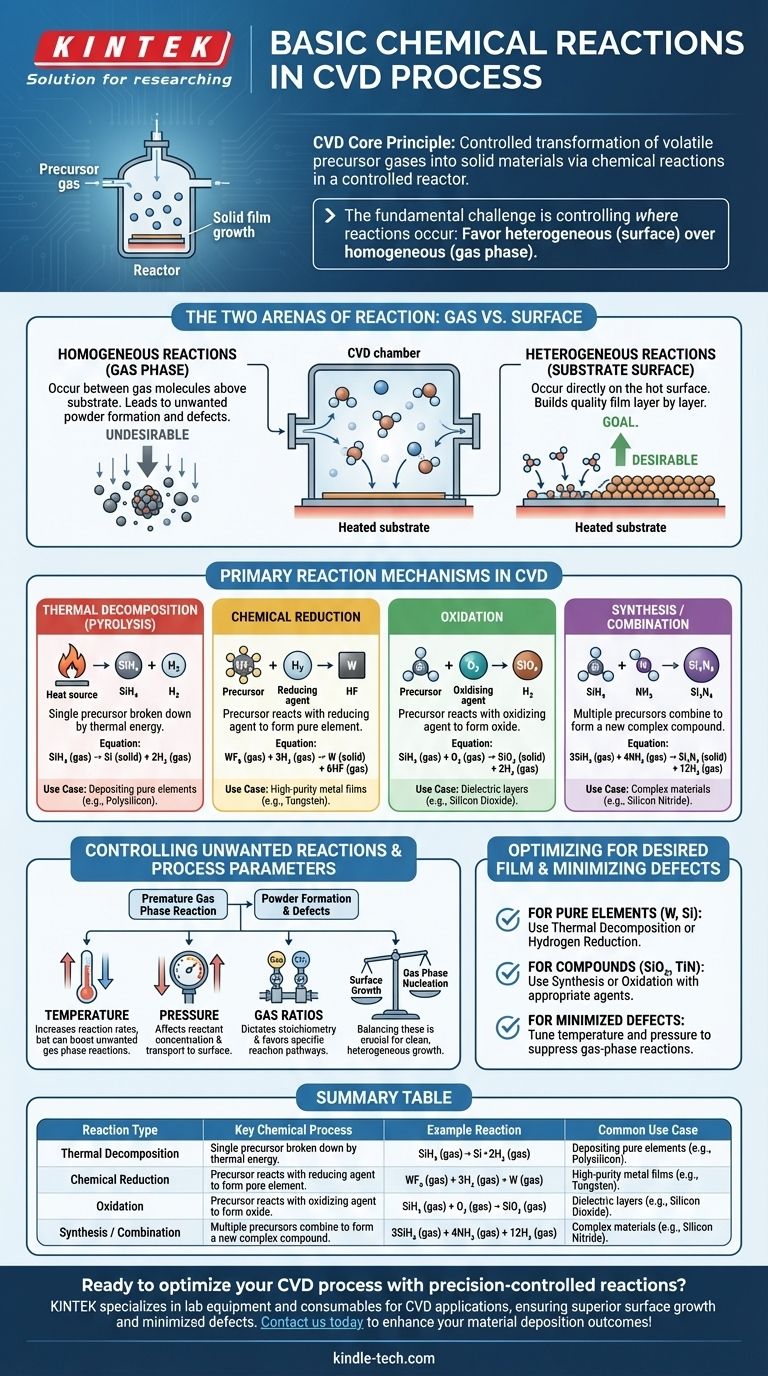
Al suo centro, la Deposizione Chimica da Vapore (CVD) è un processo di reazioni chimiche controllate. Queste reazioni sono progettate per prendere gas precursori stabili e volatili e trasformarli in un materiale solido, non volatile, direttamente su un substrato. I meccanismi più comuni che guidano questa trasformazione sono la decomposizione termica (pirolisi), la riduzione chimica, l'ossidazione e le reazioni di sintesi, tutte che avvengono all'interno di un ambiente reattore altamente controllato.
La sfida fondamentale in qualsiasi processo CVD non è solo avviare le reazioni chimiche, ma controllare con precisione dove avvengono. L'obiettivo è favorire le reazioni eterogenee sulla superficie del substrato per costruire un film di qualità, minimizzando le reazioni omogenee in fase gassosa che creano particelle indesiderate.

Le Due Arene della Reazione: Gas vs. Superficie
Ogni reazione chimica in una camera CVD avviene in uno dei due luoghi. L'equilibrio tra di essi determina la qualità e la struttura del materiale finale.
Reazioni Omogenee (In Fase Gassosa)
Queste reazioni avvengono tra le molecole di gas stesse, sospese nello spazio sopra il substrato.
Sebbene una certa chimica in fase gassosa sia necessaria per creare specie intermedie reattive, reazioni omogenee eccessive sono spesso indesiderabili. Possono portare alla formazione di particelle solide o "polveri" che poi cadono sul substrato, causando difetti e compromettendo la qualità del film.
Reazioni Eterogenee (Sulla Superficie del Substrato)
Queste sono le reazioni che costruiscono il film. Avvengono direttamente sulla, o in uno strato molto sottile adiacente alla, superficie riscaldata del substrato.
L'obiettivo di un processo CVD ben progettato è massimizzare la velocità delle reazioni eterogenee. I gas precursori si adsorbono sulla superficie calda, si decompongono o reagiscono con altre specie adsorbite, e formano il film solido stabile uno strato atomico alla volta.
Meccanismi di Reazione Primari nel CVD
Pur avvenendo in una delle due "arene" sopra, le reazioni stesse possono essere classificate in diversi tipi chiave basati sulla trasformazione chimica coinvolta.
Decomposizione Termica (Pirolisi)
Questo è il tipo di reazione CVD più semplice e comune. Un singolo gas precursore viene scomposto nelle sue parti costituenti solo per energia termica.
Il calore del substrato fornisce l'energia necessaria per rompere i legami chimici della molecola precursore, lasciando l'elemento solido desiderato depositarsi sulla superficie. Un classico esempio è la deposizione di polisilicio dal gas silano.
SiH₄ (gas) → Si (solido) + 2H₂ (gas)
Riduzione Chimica
In questo processo, un gas precursore (spesso un alogenuro metallico) reagisce con un agente riducente, tipicamente idrogeno (H₂), per formare un film elementare puro.
Questo è un metodo comune per depositare film metallici di elevata purezza come il tungsteno. L'idrogeno rimuove gli atomi di alogeno dal precursore metallico, permettendo al metallo puro di depositarsi.
WF₆ (gas) + 3H₂ (gas) → W (solido) + 6HF (gas)
Ossidazione
Questa reazione coinvolge un gas precursore che reagisce con un agente ossidante, come ossigeno (O₂), protossido di azoto (N₂O) o vapore (H₂O), per formare un film di ossido solido.
Questo è il processo fondamentale per creare strati dielettrici isolanti come il biossido di silicio (SiO₂), un componente critico in quasi tutti i microelettronici moderni.
SiH₄ (gas) + O₂ (gas) → SiO₂ (solido) + 2H₂ (gas)
Sintesi o Combinazione
Qui, due o più gas precursori vengono introdotti per combinarsi e formare un nuovo materiale composto sul substrato. Ciò consente la creazione di materiali complessi che non possono essere formati per semplice decomposizione.
Ad esempio, il nitruro di silicio (Si₃N₄), un materiale duro e chimicamente resistente, si forma facendo reagire una fonte di silicio con una fonte di azoto, come l'ammoniaca.
3SiH₄ (gas) + 4NH₃ (gas) → Si₃N₄ (solido) + 12H₂ (gas)
Comprendere i Compromessi: Controllare le Reazioni Indesiderate
Il successo di un processo CVD dipende interamente dal controllo dell'ambiente di reazione per favorire i percorsi chimici desiderati.
Il Problema della Formazione di Polvere
Il principale inconveniente nel CVD è la nucleazione in fase gassosa non intenzionale. Se la temperatura del reattore è troppo alta o la pressione è troppo elevata, i gas precursori possono reagire prematuramente in fase gassosa (reazione omogenea) prima di raggiungere il substrato. Questo crea particelle che possono causare difetti o formare un film a bassa densità, polveroso, invece di uno di alta qualità e denso.
Il Ruolo dei Parametri di Processo
Gli ingegneri utilizzano diversi parametri chiave come leve per controllare la cinetica e la posizione della reazione:
- Temperatura: Aumenta la velocità delle reazioni ma può anche aumentare le reazioni indesiderate in fase gassosa.
- Pressione: Influisce sulla concentrazione dei reagenti e sulla velocità con cui viaggiano verso la superficie.
- Rapporti Gas: Dettano la stechiometria e controllano quale percorso di reazione è favorito.
Bilanciare questi fattori è cruciale per promuovere una crescita pulita ed eterogenea sulla superficie del substrato.
Ottimizzare le Reazioni per il Film Desiderato
Il percorso di reazione chimica specifico che si impiega è determinato interamente dal materiale che si intende creare.
- Se il tuo obiettivo principale è depositare un elemento puro (es. Tungsteno, Silicio): Ti affiderai probabilmente alla decomposizione termica o a una reazione di riduzione con idrogeno utilizzando un singolo precursore ed eventualmente un agente riducente.
- Se il tuo obiettivo principale è creare un ossido o nitruro composto (es. SiO₂, TiN): Utilizzerai una reazione di sintesi o ossidazione, introducendo un agente ossidante o nitrurante insieme al tuo precursore principale.
- Se il tuo obiettivo principale è minimizzare i difetti e ottenere un film di alta qualità: Il tuo compito principale è regolare temperatura e pressione per sopprimere le reazioni omogenee in fase gassosa e promuovere una crescita pulita ed eterogenea sul substrato.
In definitiva, padroneggiare il CVD significa padroneggiare l'arte di dirigere la chimica affinché avvenga in un momento e in un luogo specifici.
Tabella Riepilogativa:
| Tipo di Reazione | Processo Chimico Chiave | Esempio di Reazione | Caso d'Uso Comune |
|---|---|---|---|
| Decomposizione Termica (Pirolisi) | Un singolo precursore si scompone tramite calore | SiH₄ (gas) → Si (solido) + 2H₂ (gas) | Deposizione di elementi puri come il polisilicio |
| Riduzione Chimica | Il precursore reagisce con un agente riducente (es. H₂) | WF₆ (gas) + 3H₂ (gas) → W (solido) + 6HF (gas) | Film metallici di elevata purezza (es. tungsteno) |
| Ossidazione | Il precursore reagisce con un agente ossidante (es. O₂) | SiH₄ (gas) + O₂ (gas) → SiO₂ (solido) + 2H₂ (gas) | Strati dielettrici come il biossido di silicio |
| Sintesi/Combinazione | Più precursori si combinano per formare un composto | 3SiH₄ (gas) + 4NH₃ (gas) → Si₃N₄ (solido) + 12H₂ (gas) | Materiali complessi come il nitruro di silicio |
Pronto a ottimizzare il tuo processo CVD con reazioni controllate con precisione? KINTEK è specializzata in apparecchiature da laboratorio e materiali di consumo per applicazioni CVD, aiutandoti a ottenere film sottili privi di difetti attraverso soluzioni di reattori su misura. Che tu stia depositando metalli, ossidi o nitruri, la nostra esperienza garantisce una crescita superficiale superiore e difetti in fase gassosa minimizzati. Contattaci oggi stesso per discutere come i nostri sistemi CVD possono migliorare i risultati della tua deposizione di materiali!
Guida Visiva
Prodotti correlati
- Macchina per forni a tubo per deposizione chimica da vapore potenziata al plasma rotante inclinato PECVD
- Apparecchiatura per macchine HFCVD per rivestimento di nano-diamante per matrici di trafilatura
- 915MHz MPCVD Diamond Machine Sistema di deposizione chimica da vapore al plasma a microonde Reattore
- Macchina per forni a pressa sottovuoto per laminazione e riscaldamento
- Materiali diamantati drogati con boro tramite CVD
Domande frequenti
- Come vengono depositati i film sottili? Una guida ai metodi PVD vs. CVD per la vostra applicazione
- Quali sono i diversi tipi di film sottili? Una guida a funzione, materiale e metodi di deposizione
- Quali sono le capacità di processo dei sistemi ICPCVD? Ottenere deposizione di film a basso danneggiamento a temperature ultra-basse
- Perché un sistema a vuoto PECVD richiede sia una pompa a palette che una pompa turbo? Garantire rivestimenti ad alta purezza
- La CVD potenziata al plasma può depositare metalli? Perché la PECVD è raramente usata per la deposizione di metalli



















