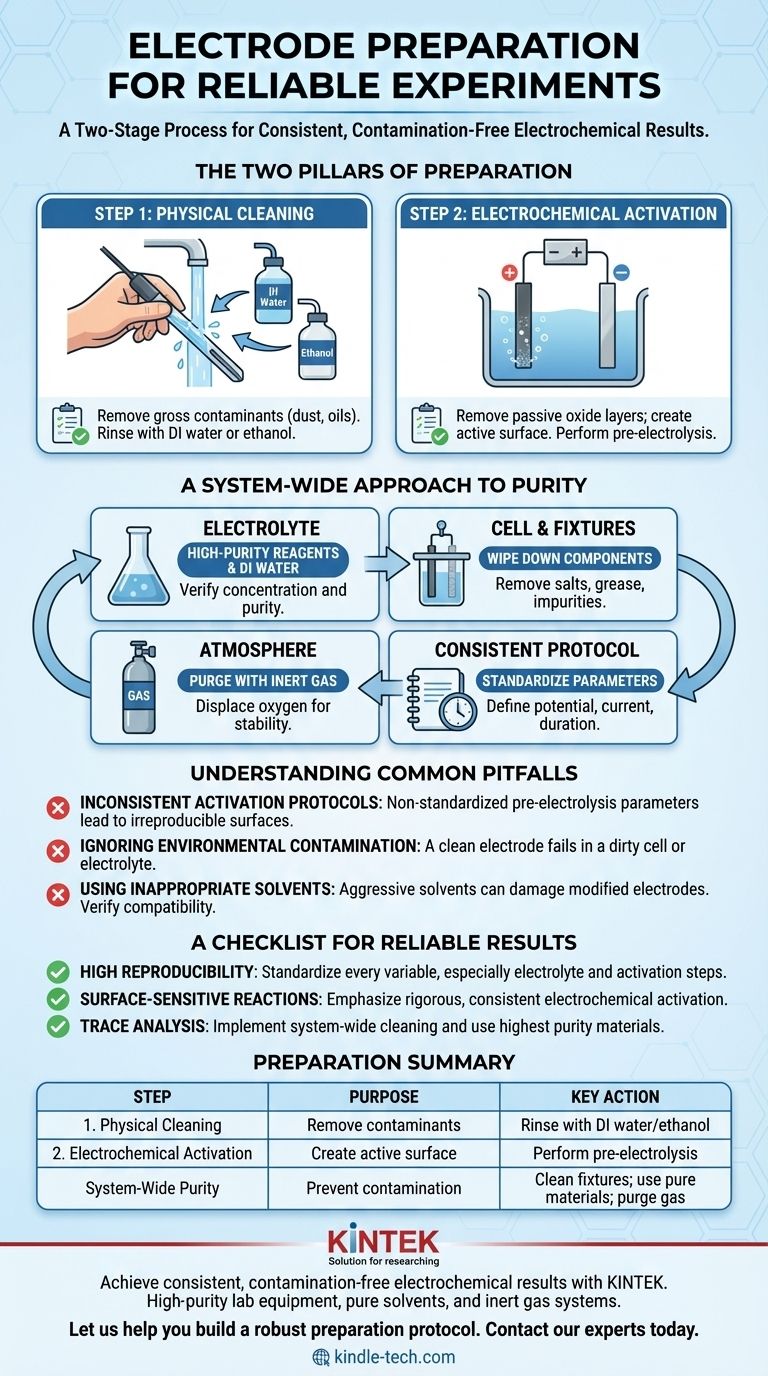
Per preparare correttamente gli elettrodi, è necessario eseguire un processo in due fasi. In primo luogo, eseguire una pulizia fisica della superficie dell'elettrodo utilizzando un solvente come acqua deionizzata o etanolo per rimuovere eventuali impurità grossolane. In secondo luogo, eseguire un'attivazione elettrochimica, spesso tramite pre-elettrolisi nel proprio elettrolita, per rimuovere gli strati di ossido passivi e creare una superficie uniformemente reattiva per l'esperimento.
Il principio fondamentale della preparazione dell'elettrodo non è solo pulire l'elettrodo stesso, ma assicurarsi che l'intero sistema elettrochimico — l'elettrodo, l'elettrolita e la cella — sia privo di contaminanti e che la superficie dell'elettrodo sia in uno stato noto e attivo prima di iniziare.

I due pilastri della preparazione dell'elettrodo
Una misurazione elettrochimica affidabile dipende interamente dallo stato della superficie dell'elettrodo. L'obiettivo è rendere tale superficie sia pulita che elettrochimicamente attiva in modo riproducibile. Ciò si ottiene attraverso due passaggi distinti ma ugualmente importanti.
Fase 1: Pulizia fisica
Questa fase iniziale mira a rimuovere eventuali contaminanti esterni che potrebbero essersi accumulati sull'elettrodo durante lo stoccaggio o la manipolazione.
I contaminanti comuni includono polvere, oli derivanti dalla manipolazione o residui di esperimenti precedenti. Una semplice pulizia o risciacquo con un solvente di elevata purezza è generalmente sufficiente.
L'acqua deionizzata (DI) è un solvente universale per sali e residui polari. L'etanolo è efficace per rimuovere pellicole organiche e grasso. La scelta dipende dai probabili contaminanti e dalla resistenza chimica del materiale dell'elettrodo.
Fase 2: Attivazione elettrochimica
La pulizia fisica non è sufficiente. La maggior parte degli elettrodi metallici forma un sottile strato di ossido passivo e non conduttivo quando esposta all'aria. L'attivazione rimuove questo strato e prepara la superficie per il trasferimento di elettroni.
Questo viene fatto più spesso tramite pre-elettrolisi. Facendo scorrere una corrente attraverso la cella per un breve periodo prima dell'esperimento principale, è possibile ridurre elettrochimicamente gli ossidi superficiali, creando una superficie metallica fresca e altamente attiva.
Il potenziale e la durata esatti dell'attivazione devono essere determinati per il tuo sistema specifico e, soprattutto, mantenuti coerenti in tutti gli esperimenti per garantire la riproducibilità.
Un approccio a livello di sistema alla purezza
Un elettrodo preparato perfettamente fallirà in un ambiente contaminato. Un vero controllo sperimentale richiede di considerare ogni componente che interagisce con la tua reazione elettrochimica.
L'elettrolita: la purezza è fondamentale
Il tuo elettrolita è un partecipante attivo nella reazione. Le impurità possono introdurre reazioni secondarie indesiderate, avvelenare la superficie dell'elettrodo o alterare il processo stesso che si intende misurare.
Utilizzare sempre reagenti chimici di elevata purezza e acqua deionizzata o distillata. La concentrazione e la purezza devono essere verificate per soddisfare i tuoi standard sperimentali.
La cella e gli accessori: prevenire la contaminazione incrociata
La contaminazione non proviene solo dalle sostanze chimiche. L'apparato fisico è una fonte comune di errore.
Prima dell'assemblaggio, pulire tutti i componenti — morsetti per elettrodi, corpo della cella elettrolitica e tutti gli accessori — con acqua deionizzata o alcol. Ciò rimuove sali residui, grasso o altre impurità che potrebbero fuoriuscire nell'elettrolita.
Controllo dell'atmosfera
Molte reazioni elettrochimiche sono altamente sensibili all'ossigeno. L'ossigeno atmosferico può dissolversi nell'elettrolita e agire come un agente ossidante indesiderato, creando interferenze significative.
Se il tuo esperimento è sensibile all'aria, spurgare la cella con un gas inerte come azoto o argon prima e durante l'esperimento. Questo sposta l'ossigeno e fornisce un ambiente stabile e non reattivo.
Comprendere le insidie comuni
Una preparazione meticolosa previene esperimenti falliti. Essere consapevoli degli errori comuni è essenziale per sviluppare un protocollo robusto.
Protocolli di attivazione incoerenti
Il termine "un breve periodo" di pre-elettrolisi è insufficiente per una scienza riproducibile. Il potenziale, la densità di corrente e la durata della fase di attivazione influenzano direttamente lo stato finale della superficie dell'elettrodo. Questi parametri devono essere standardizzati.
Ignorare la contaminazione ambientale
Il fallimento più comune è concentrarsi solo sull'elettrodo ignorando la cella e l'elettrolita. Un elettrodo perfettamente attivato inserito in un elettrolita contaminato da vetreria o accessori sporchi produrrà dati privi di significato.
Utilizzo di solventi inappropriati
Sebbene etanolo e acqua DI siano comuni, non sono universalmente sicuri. Alcuni elettrodi modificati, leganti o rivestimenti polimerici possono essere danneggiati da solventi aggressivi. Verificare sempre la compatibilità del solvente con il materiale specifico dell'elettrodo.
Una checklist per risultati affidabili
La tua strategia di preparazione dovrebbe allinearsi con il tuo obiettivo sperimentale primario. Utilizza questi punti come guida per costruire la tua procedura operativa standard.
- Se il tuo obiettivo principale è un'elevata riproducibilità: standardizza ogni variabile, in particolare il lotto di elettrolita, la procedura di pulizia e il potenziale esatto e la durata dell'attivazione elettrochimica.
- Se il tuo obiettivo principale è studiare reazioni sensibili alla superficie: enfatizza una rigorosa attivazione elettrochimica per assicurarti di iniziare ogni esperimento con uno stato superficiale noto e identico.
- Se il tuo obiettivo principale è prevenire la contaminazione nelle analisi di tracce: implementa la pulizia dell'intero sistema di celle e accessori e utilizza l'elettrolita e i solventi della massima purezza disponibili.
Questa preparazione diligente è la base su cui si fondano tutti i dati elettrochimici attendibili.
Tabella riassuntiva:
| Fase | Scopo | Azione chiave |
|---|---|---|
| 1. Pulizia fisica | Rimuovere contaminanti grossolani (polvere, oli) | Risciacquare con acqua DI o etanolo |
| 2. Attivazione elettrochimica | Rimuovere strati di ossido passivi; creare superficie attiva | Eseguire pre-elettrolisi nell'elettrolita |
| Purezza a livello di sistema | Prevenire la contaminazione da cella/ambiente | Pulire gli accessori; utilizzare elettrolita puro; spurgare con gas inerte se necessario |
Ottieni risultati elettrochimici coerenti e privi di contaminazione con KINTEK.
Una corretta preparazione degli elettrodi è fondamentale per dati affidabili. KINTEK è specializzata in apparecchiature e materiali di consumo di elevata purezza per laboratorio — incluse celle elettrochimiche, solventi puri e sistemi a gas inerte — per supportare le tue precise esigenze sperimentali.
Lascia che ti aiutiamo a costruire un protocollo di preparazione robusto. Contatta oggi i nostri esperti per discutere le esigenze specifiche del tuo laboratorio e assicurarti che i tuoi esperimenti inizino su una base solida.
Guida Visiva
Prodotti correlati
- Elettrodi di Riferimento Calomel Argento Cloruro Solfato di Mercurio per Uso di Laboratorio
- Elettrodo Elettrochimico in Carbonio Vetroso
- Elettrodo di riferimento al solfato di rame per uso di laboratorio
- Elettrodo a foglio di platino per applicazioni di laboratorio e industriali
- Elettrodo a disco d'oro
Domande frequenti
- Perché e come dovrebbero essere calibrati gli elettrodi di una cella elettrolitica? Garantire risultati affidabili
- Qual è l'elettrodo di riferimento per mercurio-cloruro di mercurio? Scopri l'elettrodo a calomelano saturo (SCE)
- Perché l'elettrodo a calomelano saturo (SCE) viene utilizzato come elettrodo di riferimento nella ricerca sulle celle a combustibile microbiche?
- Quali sono le caratteristiche di un elettrodo a calomelano saturo per soluzioni neutre? Comprendere la sua stabilità e i suoi limiti.
- Quali sono i quattro tipi principali di sensori? Una guida alla fonte di alimentazione e al tipo di segnale



















