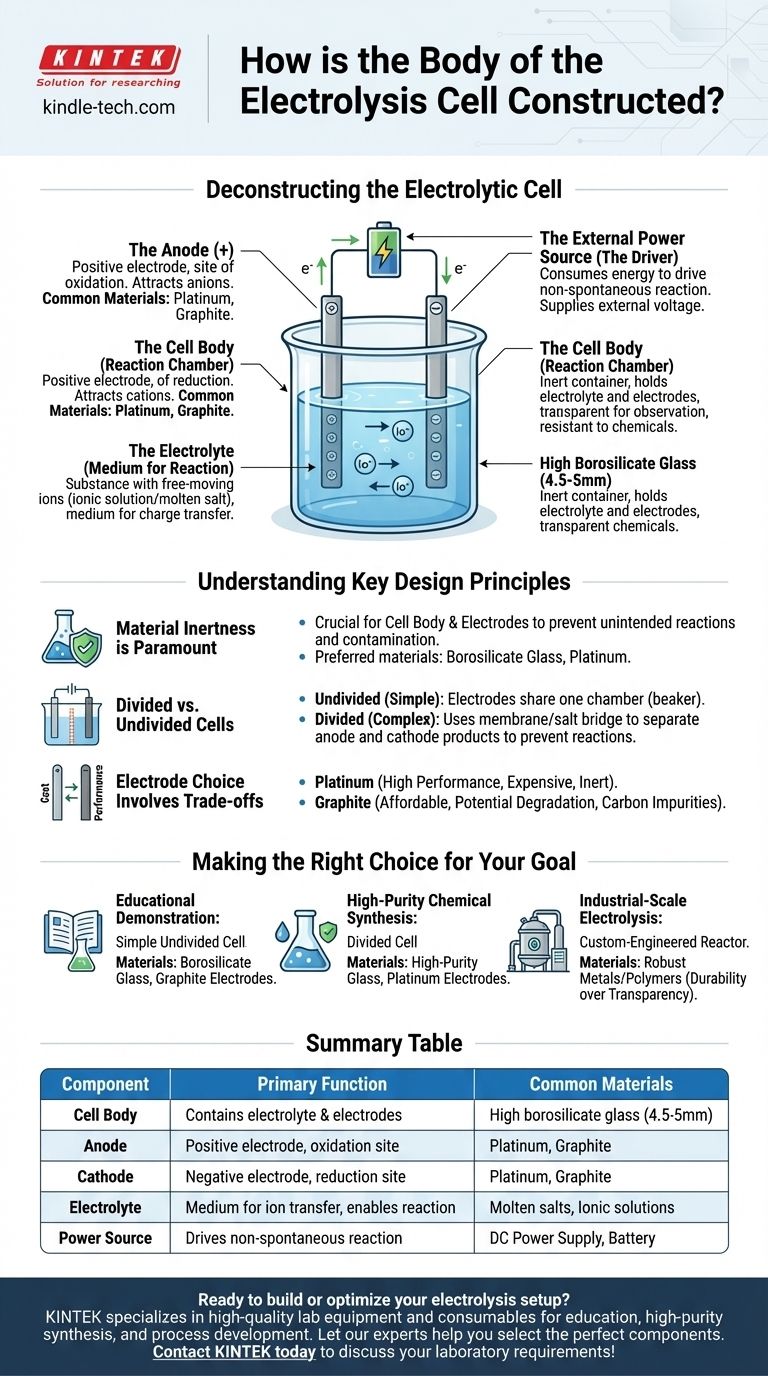
Per le applicazioni di laboratorio, il corpo di una cella elettrolitica è tipicamente costruito in vetro borosilicato ad alto tenore, spesso con uno spessore della parete di circa 4,5-5 mm. Questo materiale è scelto per la sua inerzia chimica e resistenza termica. Il contenitore fisico, tuttavia, è solo una parte di un sistema più ampio progettato per guidare una reazione chimica utilizzando l'elettricità.
Il corpo della cella è semplicemente un contenitore inerte. La vera funzione di una cella elettrolitica è definita dai suoi tre componenti interni fondamentali: due elettrodi (anodo e catodo), un elettrolita contenente ioni mobili e una fonte di alimentazione esterna per guidare la reazione.

Decostruire la Cella Elettrolitica
Per comprendere la costruzione della cella, è necessario guardare oltre il recipiente fisico e analizzare i componenti funzionali che contiene. Una cella elettrolitica è un sistema completo in cui ogni parte svolge un ruolo critico nel processo di elettrolisi.
Il Corpo della Cella (La Camera di Reazione)
La funzione principale del corpo è contenere l'elettrolita e mantenere gli elettrodi in posizione senza interferire con la reazione chimica.
Il vetro borosilicato ad alto tenore è un materiale comune perché è trasparente, consentendo l'osservazione, ed è altamente resistente alla corrosione da parte delle sostanze chimiche spesso aggressive utilizzate come elettroliti. Per applicazioni specifiche, possono essere utilizzati altri materiali inerti come alcuni polimeri.
Gli Elettrodi (L'Anodo e il Catodo)
Gli elettrodi sono i conduttori che introducono energia elettrica nel sistema. Una cella elettrolitica ne ha sempre due.
- L'Anodo è l'elettrodo positivo. Attira ioni a carica negativa (anioni) ed è il luogo in cui avviene l'ossidazione.
- Il Catodo è l'elettrodo negativo. Attira ioni a carica positiva (cationi) ed è il luogo in cui avviene la riduzione.
Questi sono tipicamente realizzati con materiali inerti, come platino o grafite, che conducono bene l'elettricità ma non partecipano prontamente alla reazione chimica stessa.
L'Elettrolita (Il Mezzo per la Reazione)
L'elettrolita è la sostanza che contiene ioni in movimento libero e riempie il corpo della cella. È il mezzo attraverso il quale viene trasferita la carica tra gli elettrodi.
Gli elettroliti possono essere un composto ionico disciolto in un solvente (come il sale in acqua) o un composto ionico fuso (come il cloruro di sodio fuso). Gli ioni specifici presenti nell'elettrolita sono quelli che verranno ossidati o ridotti durante l'elettrolisi.
La Fonte di Alimentazione Esterna (Il Motore)
A differenza di una batteria che produce energia, una cella elettrolitica consuma energia per forzare il verificarsi di una reazione non spontanea.
Questa energia è fornita da una fonte di alimentazione esterna, come una batteria o un alimentatore CC, che è collegato all'anodo e al catodo. Questa tensione esterna è ciò che spinge gli elettroni attraverso il circuito e guida gli ioni verso i rispettivi elettrodi.
Comprendere i Principi Chiave di Progettazione
La costruzione di una cella elettrolitica è guidata da principi fondamentali che ne garantiscono il corretto funzionamento. Non comprenderli può portare a esperimenti falliti o processi inefficienti.
L'Inerzia del Materiale è Fondamentale
Il principio più importante per il corpo della cella e per gli elettrodi è l'inerzia chimica. Il contenitore e i conduttori elettrici non devono reagire con l'elettrolita. Qualsiasi reazione indesiderata può contaminare i prodotti e interrompere il processo elettrochimico desiderato. Questo è il motivo per cui materiali specializzati come il vetro borosilicato e il platino sono preferiti rispetto al vetro standard o ai metalli reattivi.
Celle Divise vs. Non Divise
Il progetto di cella più semplice è una cella "non divisa", in cui entrambi gli elettrodi condividono un elettrolita comune in un unico scomparto, come un becher.
Tuttavia, a volte i prodotti formati all'anodo e al catodo possono reagire tra loro. In questi casi, viene utilizzata una cella "divisa". Questo design incorpora una membrana porosa o un ponte salino per separare la cella in due semicelle distinte, mantenendo isolati i prodotti pur consentendo il flusso di ioni tra i compartimenti.
La Scelta dell'Elettrodo Comporta dei Compromessi
Sebbene entrambi siano comuni, la scelta tra elettrodi di platino e grafite comporta un classico compromesso tra costo e prestazioni.
Il platino è estremamente inerte ed efficiente ma molto costoso. La grafite è un conduttore molto più economico ma può degradarsi o reagire in determinate condizioni, specialmente ad alte tensioni o con elettroliti specifici, introducendo potenzialmente impurità di carbonio nel sistema.
Fare la Scelta Giusta per il Tuo Obiettivo
La costruzione ottimale di una cella elettrolitica dipende interamente dalla sua applicazione prevista.
- Se il tuo obiettivo principale è la dimostrazione didattica: Un semplice becher non diviso in vetro borosilicato con elettrodi in grafite economici è perfettamente sufficiente ed economicamente vantaggioso.
- Se il tuo obiettivo principale è la sintesi chimica di elevata purezza: Una cella divisa realizzata in vetro di elevata purezza con elettrodi di platino stabili e inerti è essenziale per prevenire la contaminazione del prodotto e reazioni secondarie.
- Se il tuo obiettivo principale è l'elettrolisi su scala industriale: La cella sarà un reattore altamente specializzato e progettato su misura, spesso costruito con metalli o polimeri robusti progettati per la durata, l'efficienza e il funzionamento continuo piuttosto che per la trasparenza.
Comprendere questi componenti principali e le loro funzioni ti consente di selezionare o progettare una cella che corrisponda esattamente al tuo obiettivo.
Tabella Riassuntiva:
| Componente | Funzione Principale | Materiali Comuni |
|---|---|---|
| Corpo della Cella | Contiene l'elettrolita e gli elettrodi | Vetro borosilicato ad alto tenore (4,5-5 mm) |
| Anodo | Elettrodo positivo; sito di ossidazione | Platino, Grafite |
| Catodo | Elettrodo negativo; sito di riduzione | Platino, Grafite |
| Elettrolita | Mezzo per il trasferimento ionico; abilita la reazione | Sali fusi, Soluzioni ioniche |
| Fonte di Alimentazione | Guida la reazione non spontanea | Alimentatore CC, Batteria |
Pronto a costruire o ottimizzare il tuo setup di elettrolisi? La corretta costruzione della cella è fondamentale per il successo del tuo laboratorio, sia che si tratti di istruzione, sintesi di elevata purezza o sviluppo di processi. KINTEK è specializzata nella fornitura di attrezzature e materiali di consumo di laboratorio di alta qualità di cui hai bisogno: dalla vetreria borosilicata resistente agli elettrodi inerti in platino e grafite. Lascia che i nostri esperti ti aiutino a selezionare i componenti perfetti per la tua applicazione specifica. Contatta KINTEK oggi stesso per discutere le tue esigenze di laboratorio!
Guida Visiva
Prodotti correlati
- Bagno d'acqua a doppio strato a cinque porte Cella elettrolitica elettrochimica
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Celle Elettrolitiche PEM Personalizzabili per Diverse Applicazioni di Ricerca
- Cella Elettrochimica Elettrolitica a Bagno d'Acqua a Doppio Strato
Domande frequenti
- Quali sono le procedure dopo l'uso di una cella elettrolitica a doppio strato a bagno d'acqua? Garantire la longevità delle apparecchiature e l'accuratezza dei dati
- Quando è necessaria una riparazione professionale per una cella elettrolitica a doppio strato a bagno d'acqua? Proteggi la precisione e la sicurezza del tuo laboratorio
- Quali sono le specifiche standard di apertura della cella elettrolitica? Dimensioni chiave per la tua configurazione elettrochimica
- Quali sono i volumi tipici e le configurazioni di apertura per una cella elettrolitica a doppio strato a bagno d'acqua? Ottimizza la tua configurazione elettrochimica
- Qual è il sistema sperimentale tipico utilizzato con una cella elettrolitica a doppio bagno d'acqua? Ottenere un controllo elettrochimico preciso



















