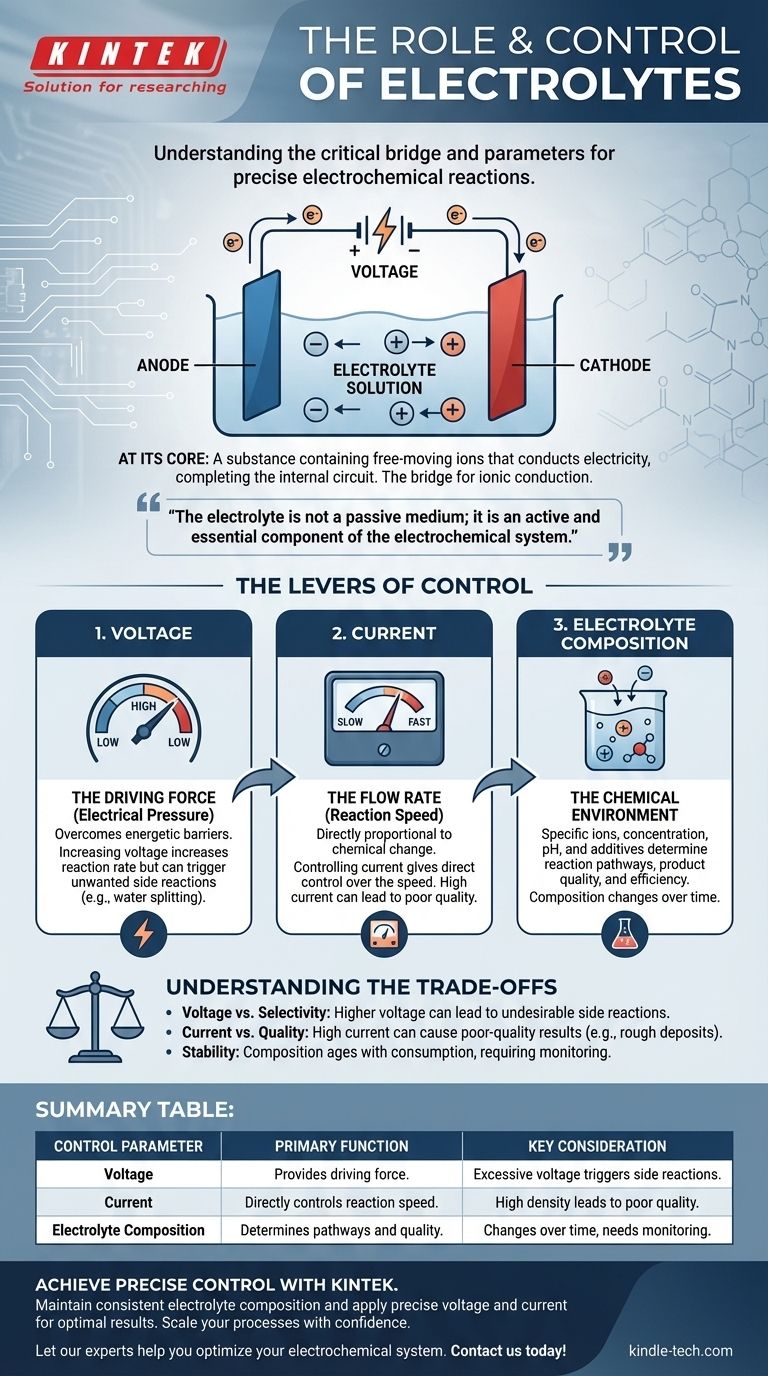
In sostanza, un elettrolita è una sostanza contenente ioni liberi che conduce l'elettricità, completando il circuito all'interno di una cella elettrochimica. È il ponte critico che consente a una reazione chimica di essere guidata da una fonte di alimentazione esterna. La reazione stessa è controllata con precisione regolando tre parametri chiave: la tensione applicata, la corrente risultante e la composizione chimica dell'elettrolita.
L'elettrolita non è un mezzo passivo; è un componente attivo ed essenziale del sistema elettrochimico. Comprendere come manipolare gli input elettrici e la chimica dell'elettrolita è la chiave per trasformare una reazione da un processo di forza bruta in un'operazione controllata con precisione.

Il ruolo fondamentale dell'elettrolita
Per controllare un sistema, devi prima comprenderne i componenti non negoziabili. In elettrochimica, l'elettrolita è il percorso interno che rende possibile l'intero processo.
Cos'è un elettrolita?
Un elettrolita è tipicamente una soluzione contenente sali, acidi o basi disciolti, che si dissociano in cationi carichi positivamente e anioni carichi negativamente. Sebbene spesso sia una soluzione acquosa (a base d'acqua), può anche essere basata su solventi organici o persino esistere come sali fusi ad alte temperature.
La proprietà chiave è la presenza di ioni mobili. Senza di essi, il circuito interno è interrotto e nessuna reazione elettrochimica può verificarsi.
Il ponte per la conduzione ionica
Una cella elettrochimica ha due circuiti. Il circuito esterno è il cablaggio attraverso il quale gli elettroni viaggiano da un elettrodo all'altro.
Il circuito interno è l'elettrolita. Quando gli elettroni arrivano a un elettrodo (il catodo) e partono dall'altro (l'anodo), gli ioni devono muoversi attraverso l'elettrolita per bilanciare la carica. I cationi si muovono verso il catodo e gli anioni si muovono verso l'anodo, completando il circuito elettrico.
Più che un semplice conduttore
L'elettrolita partecipa attivamente anche alla reazione. La sua composizione determina quali specie chimiche sono disponibili per essere ossidate o ridotte, quali saranno i prodotti della reazione e quanto velocemente la reazione può procedere.
Le leve di controllo: come gestire la reazione
Controllare una reazione elettrochimica significa manipolare la velocità e l'esito dei cambiamenti chimici che avvengono agli elettrodi. Ciò si ottiene gestendo le proprietà elettriche e chimiche del sistema.
Controllo della tensione (la forza motrice)
La tensione può essere pensata come la "pressione elettrica" che spinge la reazione in avanti. È necessaria una certa tensione minima per superare la barriera energetica di una reazione specifica.
L'aumento della tensione generalmente aumenta la velocità di reazione. Tuttavia, l'applicazione di una tensione eccessiva è uno strumento grossolano che può innescare reazioni collaterali indesiderate.
Controllo della corrente (la portata)
La corrente è la misura di quanti elettroni fluiscono attraverso il circuito per unità di tempo. Secondo le leggi di Faraday sull'elettrolisi, la quantità di cambiamento chimico è direttamente proporzionale alla quantità di carica passata.
Pertanto, il controllo della corrente ti dà il controllo diretto sulla velocità della reazione. Una corrente costante (controllo galvanostatico) assicura che la reazione proceda a un ritmo costante e prevedibile.
Regolazione della composizione dell'elettrolita (l'ambiente chimico)
Questo è il livello di controllo più sfumato. Gli ioni specifici, la loro concentrazione, il solvente e gli eventuali additivi modificano fondamentalmente l'ambiente di reazione.
I fattori chiave includono la concentrazione (che influisce sulla conduttività e sulla disponibilità di ioni), il pH (che può dettare quali reazioni sono possibili in acqua) e la presenza di additivi specializzati che possono inibire la corrosione, rendere più brillante una finitura placcata o modificare in altro modo il risultato.
Comprendere i compromessi
Un controllo preciso richiede la consapevolezza delle limitazioni e delle conseguenze di ogni regolazione. Spingere un parametro al suo estremo spesso compromette un altro.
Il problema della tensione vs. selettività
Mentre una tensione più alta aumenta la velocità, può anche fornire energia sufficiente per avviare reazioni indesiderate. Ad esempio, in una soluzione acquosa, una tensione eccessiva può iniziare a scindere l'acqua in idrogeno e ossigeno, consumando energia e riducendo l'efficienza del tuo obiettivo primario.
Densità di corrente e qualità
Spingere per una corrente molto alta (e quindi una velocità di reazione elevata) può portare a risultati di scarsa qualità. Nell'elettrodeposizione, una corrente troppo alta può causare l'esaurimento degli ioni vicino alla superficie dell'elettrodo, con conseguente deposito ruvido, poroso o bruciato. La qualità spesso richiede pazienza e una densità di corrente inferiore.
Stabilità e durata dell'elettrolita
L'elettrolita non è statico. La sua composizione cambia durante la reazione man mano che gli ioni vengono consumati e i contaminanti vengono introdotti. I solventi possono evaporare e gli additivi possono esaurirsi. Questo "invecchiamento" dell'elettrolita è una fonte primaria di inconsistenza nei processi industriali a lungo termine e richiede monitoraggio e manutenzione.
Fare la scelta giusta per il tuo obiettivo
La tua strategia di controllo dipende interamente da ciò che vuoi ottenere. Usa questi principi per guidare il tuo approccio.
- Se il tuo obiettivo principale è massimizzare la velocità di reazione: Usa una corrente più alta e assicurati che la concentrazione dell'elettrolita sia sufficientemente elevata per supportare questa velocità senza un significativo esaurimento degli ioni vicino agli elettrodi.
- Se il tuo obiettivo principale è ottenere alta precisione o qualità: Usa una densità di corrente inferiore e attentamente controllata o applica una tensione specifica (controllo potenziostatico) per assicurarti che la reazione proceda in modo fluido e selettivo.
- Se il tuo obiettivo principale è risolvere un processo incoerente: Inizia analizzando l'elettrolita. La sua composizione, concentrazione e potenziale contaminazione sono le fonti più comuni di variabilità del processo.
Padroneggiare questi principi trasforma un processo elettrochimico da una scatola nera a un sistema precisamente sintonizzabile.
Tabella riassuntiva:
| Parametro di controllo | Funzione primaria | Considerazione chiave |
|---|---|---|
| Tensione | Fornisce la forza motrice per la reazione. | Una tensione eccessiva può innescare reazioni collaterali indesiderate. |
| Corrente | Controlla direttamente la velocità della reazione. | Un'alta densità di corrente può portare a risultati di scarsa qualità. |
| Composizione dell'elettrolita | Determina i percorsi di reazione e la qualità del prodotto. | La composizione cambia nel tempo, richiedendo monitoraggio. |
Pronto a ottenere un controllo preciso sui tuoi processi elettrochimici?
In KINTEK, siamo specializzati nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità di cui hai bisogno per padroneggiare le tue reazioni. Che tu stia sviluppando nuovi materiali, eseguendo elettrodeposizione o conducendo ricerche, le nostre soluzioni ti aiutano a:
- Mantenere una composizione elettrolitica costante per risultati affidabili.
- Applicare un controllo preciso di tensione e corrente per una selettività e una qualità ottimali.
- Scalare i tuoi processi dal banco di laboratorio alla produzione con fiducia.
Lascia che i nostri esperti ti aiutino a ottimizzare il tuo sistema elettrochimico. Contattaci oggi per discutere la tua applicazione e le tue sfide specifiche!
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica a Diffusione di Gas Cella di Reazione a Flusso Liquido
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica in PTFE Cella Elettrochimica Resistente alla Corrosione Sigillata e Non Sigillata
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
Domande frequenti
- Quali vantaggi offrono le celle elettrolitiche a flusso rispetto alle celle di tipo H? Ottimizzare l'efficienza dell'elettrolisi della CO2
- Quali funzioni svolgono le celle elettrolitiche nella scissione dell'acqua PEC? Ottimizza la tua ricerca fotoelettrochimica
- Quali parametri devono essere rigorosamente controllati utilizzando una cella elettrolitica interamente in PTFE? Garantire precisione e sicurezza
- Qual è lo scopo dell'utilizzo di un tubo di vetro sinterizzato in una cella a tre elettrodi? Migliorare l'accuratezza dei test redox del vanadio
- Qual è lo scopo della struttura a doppio strato nella cella elettrolitica di tipo H? Ottenere un controllo termico preciso



















