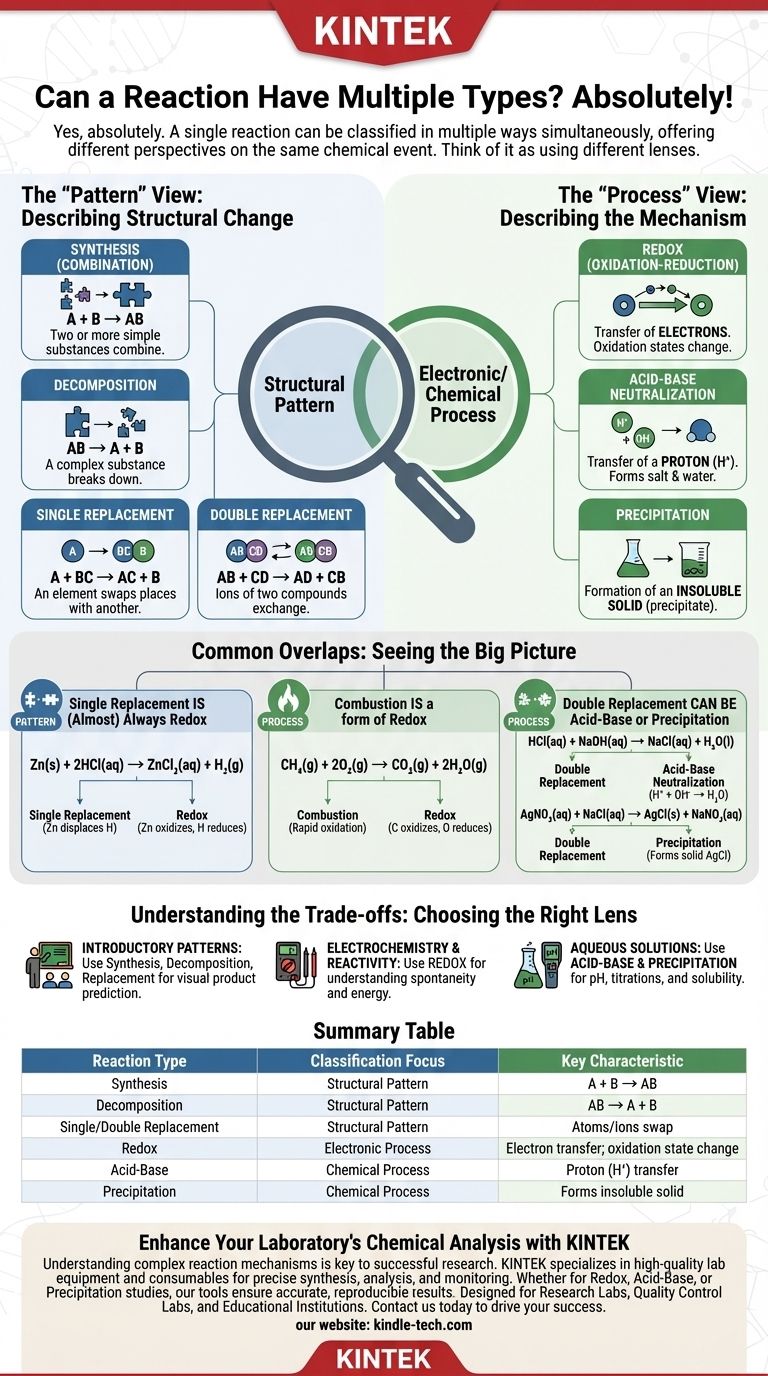
Sì, assolutamente. Una singola reazione chimica può spesso essere classificata come di più tipi di reazione contemporaneamente. Questo è un punto comune di confusione perché la chimica introduttiva spesso presenta i tipi di reazione come categorie mutualmente esclusive, ma una comprensione più avanzata rivela che sono semplicemente diverse lenti per analizzare lo stesso evento chimico.
La chiave è capire che alcuni tipi di reazione descrivono il modello strutturale di come gli atomi si riorganizzano (come la sintesi o la decomposizione), mentre altri descrivono il processo elettronico o chimico sottostante (come redox o acido-base). Una singola reazione può esibire sia un modello specifico che un processo specifico.

Perché le etichette semplici non sono sufficienti
Il modo in cui classifichiamo le reazioni dipende da ciò che vogliamo capire di esse. Le categorie semplici apprese per prime sono utili per riconoscere i modelli visivi, ma non sempre spiegano il cambiamento chimico fondamentale.
La visione "Modello": Descrivere il cambiamento strutturale
All'inizio della tua formazione chimica, impari a riconoscere le reazioni da come i reagenti formano i prodotti. Queste categorie descrivono la "forma" complessiva della trasformazione.
I principali tipi basati sul modello sono:
- Sintesi (o Combinazione): Due o più sostanze semplici si combinano per formare un prodotto più complesso (
A + B → AB). - Decomposizione: Una sostanza complessa si scompone in sostanze più semplici (
AB → A + B). - Sostituzione Semplice: Un elemento scambia posto con un altro in un composto (
A + BC → AC + B). - Sostituzione Doppia: Gli ioni di due composti si scambiano di posto per formare due nuovi composti (
AB + CD → AD + CB).
Queste etichette sono eccellenti per prevedere rapidamente i prodotti basandosi su un modello familiare.
La visione "Processo": Descrivere il meccanismo
Classificazioni più sofisticate descrivono come avviene la trasformazione a livello molecolare o elettronico. Si concentrano sul processo fondamentale che guida la reazione.
I principali tipi basati sul processo includono:
- Redox (Ossidazione-Riduzione): Questo tipo coinvolge il trasferimento di elettroni. Gli stati di ossidazione di uno o più elementi cambiano durante la reazione.
- Neutralizzazione Acido-Base: Un acido e una base reagiscono, tipicamente coinvolgendo il trasferimento di un protone (ione H⁺) per formare un sale e acqua.
- Precipitazione: Due soluzioni acquose vengono mescolate e si forma un solido insolubile (un precipitato).
Queste etichette sono essenziali per comprendere le forze motrici sottostanti di una reazione.
Sovrapposizioni comuni che incontrerai
Vedere come queste categorie si sovrappongono è il modo migliore per consolidare la tua comprensione. La maggior parte delle reazioni che incontrerai avrà più di un'etichetta valida.
La sostituzione semplice è (quasi) sempre Redox
Considera la reazione del metallo zinco con acido cloridrico:
Zn(s) + 2HCl(aq) → ZnCl₂(aq) + H₂(g)
Questa è una classica reazione di sostituzione semplice perché lo zinco sposta l'idrogeno. Tuttavia, è anche una reazione redox perché gli stati di ossidazione cambiano: lo zinco viene ossidato (da 0 a +2) e l'idrogeno viene ridotto (da +1 a 0).
La combustione è una forma di Redox
La combustione del metano è un buon esempio:
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
Sebbene la chiamiamo combustione, è anche fondamentalmente una reazione redox. Il carbonio viene ossidato (da -4 a +4) e l'ossigeno viene ridotto (da 0 a -2).
La sostituzione doppia può essere acido-base o precipitazione
Considera la neutralizzazione dell'acido cloridrico con idrossido di sodio:
HCl(aq) + NaOH(aq) → NaCl(aq) + H₂O(l)
Questa è una reazione di sostituzione doppia; Na⁺ e H⁺ si scambiano di posto. Ancora più importante, è l'esempio definitivo di una neutralizzazione acido-base.
Allo stesso modo, mescolando nitrato d'argento e cloruro di sodio:
AgNO₃(aq) + NaCl(aq) → AgCl(s) + NaNO₃(aq)
Questo si adatta al modello di sostituzione doppia, ma la sua caratteristica più notevole è la formazione di un solido, rendendola una reazione di precipitazione.
Comprendere i compromessi: lo scopo della classificazione
Scegliere un'etichetta non significa trovare l'unica risposta "corretta". Si tratta di utilizzare l'etichetta più descrittiva e utile per il tuo obiettivo specifico.
La limitazione dei modelli semplici
Classificare una reazione come "sostituzione semplice" ti dice cosa è successo agli atomi, ma non spiega perché è successo. Non spiega perché lo zinco reagisce con HCl ma il rame no.
Il potere delle etichette meccanicistiche
Identificare la stessa reazione come "redox" fornisce un'intuizione molto più profonda. Ti consente di utilizzare concetti come la serie di attività o i potenziali standard di elettrodo per prevedere se la reazione avverrà spontaneamente e per quantificare l'energia coinvolta. L'etichetta redox spiega il "perché".
Fare la scelta giusta per il tuo obiettivo
Usa la classificazione che meglio si adatta al tuo scopo. L'obiettivo non è trovare un'unica etichetta esclusiva, ma applicare quella più pertinente.
- Se il tuo obiettivo principale è riconoscere i modelli di base in un corso introduttivo: Attieniti a sintesi, decomposizione e sostituzione semplice/doppia per prevedere visivamente i prodotti.
- Se il tuo obiettivo principale è l'elettrochimica o la previsione della reattività: La classificazione redox è la lente più importante da usare.
- Se il tuo obiettivo principale è lavorare con soluzioni acquose, pH e titolazioni: Classificare le reazioni come acido-base o precipitazione sarà l'approccio più utile.
In definitiva, l'uso dell'etichetta giusta dipende dalla domanda specifica a cui stai cercando di rispondere sulla trasformazione chimica.
Tabella riassuntiva:
| Tipo di Reazione | Focus della Classificazione | Caratteristica Chiave |
|---|---|---|
| Sintesi | Modello Strutturale | Due o più reagenti si combinano in un unico prodotto (A + B → AB) |
| Decomposizione | Modello Strutturale | Un composto si scompone in sostanze più semplici (AB → A + B) |
| Sostituzione Semplice/Doppia | Modello Strutturale | Atomi o ioni si scambiano tra composti |
| Redox | Processo Elettronico | Coinvolge il trasferimento di elettroni; gli stati di ossidazione cambiano |
| Acido-Base | Processo Chimico | Coinvolge il trasferimento di protoni (H⁺) |
| Precipitazione | Processo Chimico | Formazione di un solido insolubile da soluzioni acquose |
Migliora l'analisi chimica del tuo laboratorio con KINTEK
Comprendere i complessi meccanismi di reazione è fondamentale per una ricerca e uno sviluppo di successo. In KINTEK, siamo specializzati nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità che supportano la sintesi chimica precisa, l'analisi e il monitoraggio dei processi. Che tu stia lavorando su reazioni redox, titolazioni acido-base o studi di precipitazione, i nostri strumenti affidabili ti aiutano a ottenere risultati accurati e riproducibili.
I nostri prodotti sono progettati per:
- Laboratori di Ricerca che richiedono un controllo preciso della temperatura per reazioni di sintesi e decomposizione.
- Laboratori di Controllo Qualità che necessitano di attrezzature coerenti per analisi acido-base e di precipitazione.
- Istituzioni Educative che cercano apparecchiature durevoli e facili da usare per l'insegnamento di tipi di reazione fondamentali e avanzati.
Lascia che KINTEK sia il tuo partner di fiducia per far progredire le capacità del tuo laboratorio. Contattaci oggi stesso per discutere le tue esigenze specifiche e scoprire come le nostre soluzioni possono guidare il tuo successo.
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica a Diffusione di Gas Cella di Reazione a Flusso Liquido
- Reattore Autoclave di Laboratorio ad Alta Pressione in Acciaio Inossidabile
- Reattori personalizzabili ad alta pressione per applicazioni scientifiche e industriali avanzate
- Termociclatore a bagno d'acqua a temperatura costante ad alta temperatura per bagno di reazione
- Mulino a Tessuto Ibrido da Laboratorio
Domande frequenti
- Quale ruolo svolge un reattore elettrochimico a due elettrodi nella crescita del TiO2? Ottieni oggi nanostrutture ordinate
- Quali parametri devono essere rigorosamente controllati utilizzando una cella elettrolitica interamente in PTFE? Garantire precisione e sicurezza
- Quali precauzioni occorre adottare riguardo alla temperatura quando si utilizza una cella elettrolitica interamente in PTFE? Garantire esperimenti sicuri e precisi
- Quali sono i vantaggi dell'utilizzo di una vasca di deposizione in PTFE per l'EPD? Ottieni una precisione di rivestimento senza pari sull'acciaio inossidabile
- Qual è lo scopo dell'utilizzo di un tubo di vetro sinterizzato in una cella a tre elettrodi? Migliorare l'accuratezza dei test redox del vanadio






