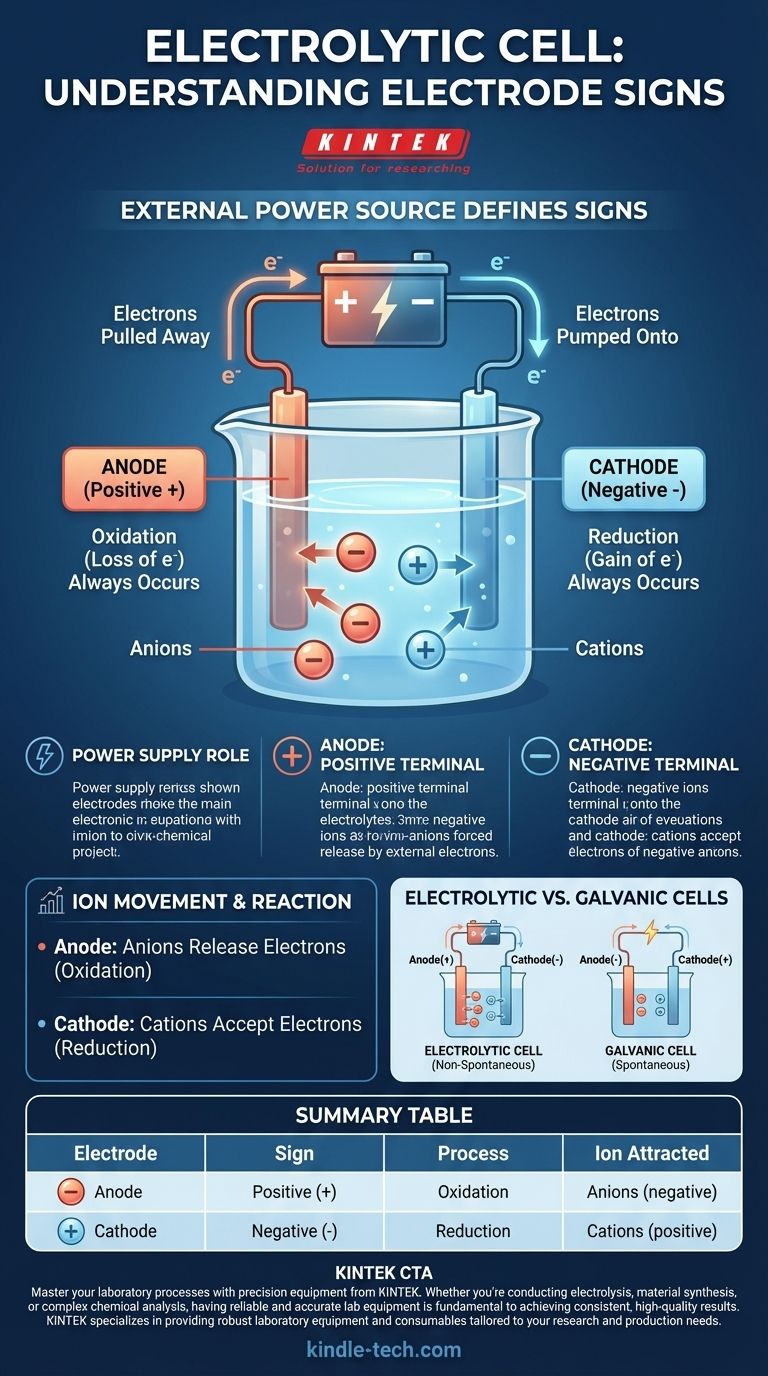
In una cella elettrolitica, la convenzione dei segni è definita dalla fonte di alimentazione esterna. All'anodo viene assegnato il segno positivo (+) e al catodo viene assegnato il segno negativo (-). Ciò è dovuto al fatto che viene applicata una tensione esterna per guidare una reazione chimica che non avverrebbe spontaneamente.
La chiave per comprendere una cella elettrolitica è riconoscere che non è un sistema autonomo. I segni dei suoi elettrodi sono dettati interamente dall'alimentatore esterno a cui è collegata, forzando il verificarsi di un cambiamento chimico non spontaneo.

Perché una fonte di alimentazione esterna definisce i segni
Una cella elettrolitica utilizza energia elettrica per creare energia chimica. Questo processo, noto come elettrolisi, richiede una forza esterna—una batteria o un alimentatore CC—per avviare e sostenere la reazione.
Il ruolo dell'alimentatore
L'alimentatore agisce come una "pompa di elettroni". Tira gli elettroni da un elettrodo e li spinge verso l'altro, creando uno squilibrio di carica che costringe gli ioni nella soluzione elettrolitica a reagire.
L'anodo è collegato al terminale positivo
Il terminale positivo dell'alimentatore esterno è collegato all'anodo. Questo terminale attira attivamente gli elettroni lontano dall'anodo, lasciandolo con una carica netta positiva.
Il catodo è collegato al terminale negativo
Al contrario, il terminale negativo dell'alimentatore è collegato al catodo. Questo terminale pompa attivamente elettroni sul catodo, conferendogli un eccesso di elettroni e una carica netta negativa.
Come il movimento degli ioni crea la reazione
Le cariche forzate sugli elettrodi sono ciò che attira gli ioni disciolti nell'elettrolita, costringendoli a muoversi e reagire. Le definizioni fondamentali di ossidazione e riduzione rimangono costanti.
Anodo: il sito dell'ossidazione (sempre)
Indipendentemente dal tipo di cella, l'ossidazione (la perdita di elettroni) si verifica sempre all'anodo. In una cella elettrolitica, gli ioni a carica negativa (anioni) sono attratti dall'anodo positivo, dove rilasciano i loro elettroni in eccesso e vengono ossidati.
Catodo: il sito della riduzione (sempre)
Allo stesso modo, la riduzione (l'acquisizione di elettroni) si verifica sempre al catodo. Gli ioni a carica positiva (cationi) nella soluzione sono attratti dal catodo negativo, dove accettano gli elettroni in eccesso e vengono ridotti.
Una distinzione critica: celle elettrolitiche vs. galvaniche
Una fonte primaria di confusione sorge quando si confrontano le celle elettrolitiche con le celle galvaniche (o voltaiche), come una batteria standard. Le loro convenzioni di segno sono opposte per un motivo molto specifico.
Reazioni spontanee vs. non spontanee
Una cella galvanica funziona con una reazione chimica spontanea che produce energia elettrica. Qui, l'anodo è la fonte naturale di elettroni, rendendolo negativo, e il catodo è dove vengono consumati, rendendolo positivo.
Una cella elettrolitica esegue una reazione non spontanea che consuma energia elettrica. La fonte di alimentazione esterna inverte la polarità naturale per forzare il procedere della reazione.
La costante universale
Nonostante la differenza nei segni, i processi fondamentali sono gli stessi in entrambi i tipi di cella:
- L'anodo è sempre il sito dell'ossidazione.
- Il catodo è sempre il sito della riduzione.
Come ricordare i segni
Usa questi principi per mantenere chiare le convenzioni in base al tuo obiettivo.
- Se il tuo obiettivo principale è identificare i terminali: Ricorda che in una cella elettrolitica, i segni corrispondono all'alimentatore esterno: l'anodo è positivo e il catodo è negativo.
- Se il tuo obiettivo principale è tracciare gli ioni: Segui la semplice regola delle cariche opposte: gli anioni negativi si muovono verso l'anodo positivo e i cationi positivi si muovono verso il catodo negativo.
- Se il tuo obiettivo principale è distinguere i tipi di cella: Associa "elettrolitico" a una fonte di alimentazione esterna che forza una carica positiva sull'anodo e una carica negativa sul catodo per guidare la reazione.
In definitiva, i segni di una cella elettrolitica sono una conseguenza diretta di una fonte di alimentazione esterna che sovrascrive il flusso naturale di una reazione chimica.
Tabella riassuntiva:
| Elettrodo | Segno | Processo | Ione attratto |
|---|---|---|---|
| Anodo | Positivo (+) | Ossidazione | Anioni (negativi) |
| Catodo | Negativo (-) | Riduzione | Cationi (positivi) |
Padroneggia i tuoi processi di laboratorio con apparecchiature di precisione KINTEK.
Sia che tu stia conducendo elettrolisi, sintesi di materiali o analisi chimiche complesse, avere apparecchiature di laboratorio affidabili e accurate è fondamentale per ottenere risultati coerenti e di alta qualità. KINTEK è specializzata nella fornitura di apparecchiature e materiali di consumo di laboratorio robusti, adattati alle tue esigenze di ricerca e produzione.
Contatta oggi i nostri esperti per discutere come le nostre soluzioni possono alimentare le tue innovazioni e migliorare l'efficienza dei tuoi flussi di lavoro di laboratorio.
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Bagno d'acqua a doppio strato a cinque porte Cella elettrolitica elettrochimica
- Cella Elettrochimica Elettrolitica a Bagno d'Acqua a Doppio Strato
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrochimica Elettrolitica a Bagno d'Acqua Ottico
Domande frequenti
- Quali precauzioni dovrebbero essere adottate per il controllo della temperatura con una cella elettrolitica a bagno d'acqua a cinque porte? Garantire esperimenti elettrochimici sicuri e accurati
- Perché utilizzare una cella a tre elettrodi per i test di corrosione dei liquidi ionici? Garantire la massima accuratezza nei mezzi acidi
- In che modo la progettazione di una cella elettrolitica influenza la valutazione delle prestazioni catalitiche elettrochimiche? Fattori chiave
- Qual è il ruolo primario di un sistema di cella elettrolitica a tre elettrodi? Ottenere precisione nell'ossidazione dei semiconduttori
- Qual è il principio di funzionamento di una cella elettrolitica per la corrosione a piastra piana? Una guida ai test sui materiali controllati
- Perché i sistemi di agitazione e raffreddamento ad acqua sono importanti per i rivestimenti di zirconia? Garantire la qualità ottimale dell'ossidazione micro-ad arco
- Quali sono i vantaggi tecnici dell'utilizzo di reattori PEM per la biomassa gassosa? Miglioramento della stabilità e della purezza
- Quali sono i requisiti di configurazione degli elettrodi per una cella E microfluidica? Ricerca sulla corrosione di precisione su micro-scala



















