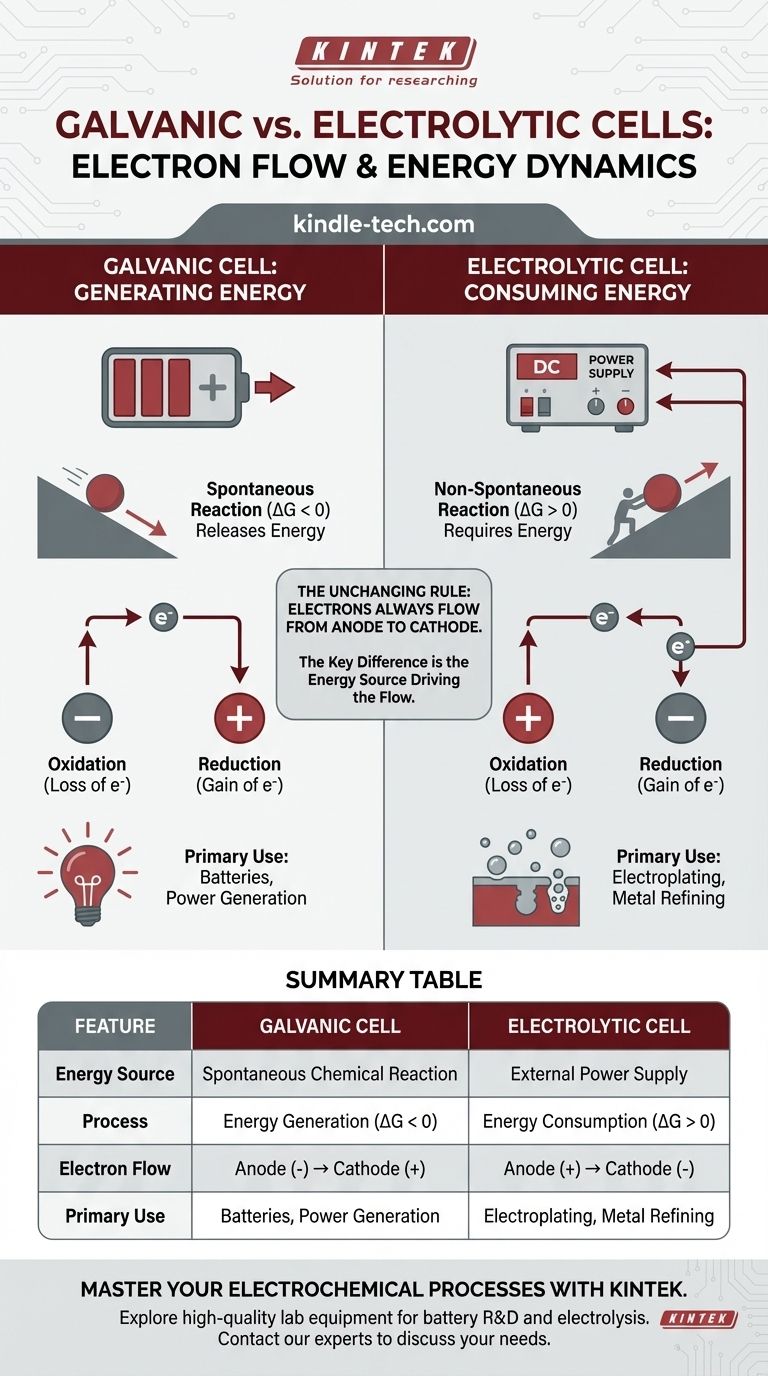
In qualsiasi cella elettrochimica, il flusso di elettroni nel circuito esterno va sempre dall'anodo al catodo. La distinzione cruciale risiede nel perché fluiscono. In una cella galvanica, una reazione chimica spontanea genera energia e spinge gli elettroni. In una cella elettrolitica, una fonte di alimentazione esterna fornisce l'energia per forzare il flusso di elettroni e guidare una reazione non spontanea.
La differenza fondamentale non è la direzione del flusso di elettroni rispetto all'ossidazione e alla riduzione, ma la fonte di energia che guida il processo. Una cella galvanica converte l'energia chimica immagazzinata in energia elettrica, mentre una cella elettrolitica utilizza energia elettrica esterna per forzare un cambiamento chimico.

Il Principio Fondamentale: Reazioni Spontanee vs. Non Spontanee
Per comprendere il flusso di elettroni, è necessario prima comprendere le dinamiche energetiche della cella. L'intero sistema è governato dal fatto che la reazione chimica avvenga da sola o debba essere forzata.
Celle Galvaniche: Generazione di Energia
Una cella galvanica (chiamata anche cella voltaica) sfrutta una reazione chimica spontanea. Pensala come una palla che rotola in discesa: il processo rilascia energia naturalmente.
Questa reazione spontanea ha un'energia libera di Gibbs negativa (ΔG < 0). Questo rilascio di energia chimica viene convertito direttamente in energia elettrica, spingendo gli elettroni dall'anodo, attraverso il circuito esterno, e al catodo.
Le celle galvaniche sono la base di tutte le batterie convenzionali.
Celle Elettrolitiche: Consumo di Energia
Una cella elettrolitica viene utilizzata per guidare una reazione chimica non spontanea. Questo è come spingere una palla in salita: richiede un costante apporto di energia esterna per avvenire.
Questa reazione ha un'energia libera di Gibbs positiva (ΔG > 0). Una fonte di alimentazione esterna, come una batteria o un alimentatore, agisce come una "pompa di elettroni". Forza gli elettroni sul catodo e li allontana dall'anodo, guidando una reazione che non si verificherebbe da sola.
Decomposizione del Flusso di Elettroni e della Polarità degli Elettrodi
La confusione intorno al flusso di elettroni spesso deriva dal cambiamento di polarità degli elettrodi. Mentre i ruoli di anodo e catodo sono fissi, le loro cariche non lo sono.
La Regola Immutabile: Anodo al Catodo
Per definizione, il sito di ossidazione (perdita di elettroni) è sempre l'anodo, e il sito di riduzione (guadagno di elettroni) è sempre il catodo.
Poiché gli elettroni vengono persi all'anodo e guadagnati al catodo, gli elettroni nel filo esterno fluiscono sempre dall'anodo al catodo. Questa è una costante universale per entrambi i tipi di celle.
La Differenza Cruciale: Carica dell'Elettrodo
La polarità (la carica positiva o negativa) degli elettrodi si inverte tra i due tipi di celle, il che è la fonte della maggior parte della confusione.
In una cella galvanica, l'anodo è il sito di ossidazione spontanea che rilascia elettroni. Questo accumulo di carica negativa rende l'anodo il terminale negativo (-). Il catodo, che consuma elettroni, diventa il terminale positivo (+).
In una cella elettrolitica, la fonte di alimentazione esterna detta la polarità. Collega il suo terminale negativo al catodo della cella per forzarvi gli elettroni e guidare la riduzione. Collega il suo terminale positivo all'anodo della cella per allontanare gli elettroni e guidare l'ossidazione.
- Cella Galvanica: Anodo (-) → Catodo (+)
- Cella Elettrolitica: Anodo (+) → Catodo (-)
Comprendere le Applicazioni Pratiche
La differenza fondamentale nella conversione di energia determina come vengono utilizzate queste celle. Una produce energia, e l'altra la consuma per produrre materiali preziosi.
Celle Galvaniche: Energia su Richiesta
Il vantaggio principale di una cella galvanica è la sua capacità di agire come fonte portatile di energia elettrica.
Sono la base per le batterie, dalle semplici pile AA a una batteria per auto. La loro principale limitazione è che i reagenti chimici vengono alla fine consumati, causando la caduta della tensione e l'esaurimento della batteria.
Celle Elettrolitiche: Forzare il Cambiamento Chimico
Lo scopo di una cella elettrolitica è utilizzare l'elettricità per creare un prodotto chimico.
Questo processo, noto come elettrolisi, è essenziale per applicazioni industriali come la raffinazione dei metalli (ad esempio, la produzione di alluminio puro), la placcatura di superfici con uno strato metallico protettivo e la scissione dell'acqua in idrogeno e ossigeno. Il loro svantaggio è la necessità di un'alimentazione continua e spesso costosa di energia elettrica.
Come Applicare Questo al Tuo Obiettivo
Il tuo approccio dipende interamente dal fatto che tu debba generare elettricità o guidare una reazione chimica.
- Se il tuo obiettivo principale è generare energia o creare una batteria: Stai lavorando con una cella galvanica, dove una reazione spontanea produce una corrente elettrica.
- Se il tuo obiettivo principale è purificare un metallo, galvanizzare una superficie o scindere un composto: Hai bisogno di una cella elettrolitica, che utilizza energia esterna per guidare una reazione non spontanea.
- Se il tuo obiettivo principale è comprendere il principio fondamentale: Ricorda che l'ossidazione avviene sempre all'anodo e la riduzione al catodo; la differenza chiave è se la reazione è spontanea (galvanica) o forzata (elettrolitica).
Comprendere questa distinzione tra rilascio di energia spontaneo e input di energia forzato è la chiave per padroneggiare le celle elettrochimiche.
Tabella Riepilogativa:
| Caratteristica | Cella Galvanica | Cella Elettrolitica |
|---|---|---|
| Fonte di Energia | Reazione Chimica Spontanea | Alimentazione Esterna |
| Processo | Generazione di Energia (ΔG < 0) | Consumo di Energia (ΔG > 0) |
| Flusso di Elettroni | Anodo (-) → Catodo (+) | Anodo (+) → Catodo (-) |
| Uso Primario | Batterie, Generazione di Energia | Galvanoplastica, Raffinazione dei Metalli |
Padroneggia i Tuoi Processi Elettrochimici con KINTEK
Sia che tu stia sviluppando nuove tecnologie per batterie o raffinando materiali tramite elettrolisi, avere la giusta attrezzatura da laboratorio è fondamentale per risultati accurati e affidabili. KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità, fornendo gli strumenti precisi di cui hai bisogno per tutta la tua ricerca e sviluppo elettrochimico.
Lasciaci aiutarti a equipaggiare il tuo laboratorio per il successo. Contatta i nostri esperti oggi stesso per discutere le tue esigenze specifiche e scoprire come KINTEK può supportare il tuo lavoro innovativo.
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrolitica in PTFE Cella Elettrochimica Resistente alla Corrosione Sigillata e Non Sigillata
Domande frequenti
- Come deve essere maneggiata una cella elettrolitica interamente in PTFE per prevenire danni meccanici? Proteggi il tuo investimento e l'integrità dei dati
- Quali sono i vantaggi dell'utilizzo di una cella elettrochimica in PTFE nella ricerca sugli attinidi? Garantire dati precisi sulla corrosione
- Quali tipi di elettrodi vengono tipicamente utilizzati nella cella elettrolitica Raman in situ? Ottimizza la tua configurazione spettroscopica
- Qual è il processo di elettrodeposizione di nanomateriali? Ottenere rivestimenti nanometrici precisi
- Come il design di una cella elettrolitica a tre elettrodi garantisce la stabilità del catalizzatore HER? Isolamento per l'accuratezza
- Quale ruolo svolge una cella elettrolitica di vetro a tre elettrodi nei catalizzatori IrSn/MMT? Ottimizzare le prestazioni di screening OER
- Qual è il modo corretto di maneggiare i componenti in vetro della cella elettrolitica? Garantire esperimenti sicuri e accurati
- Qual è il motivo principale per scegliere il vetro al quarzo come finestra ottica in un reattore PEC? Massimizzare la trasmissione UV



















