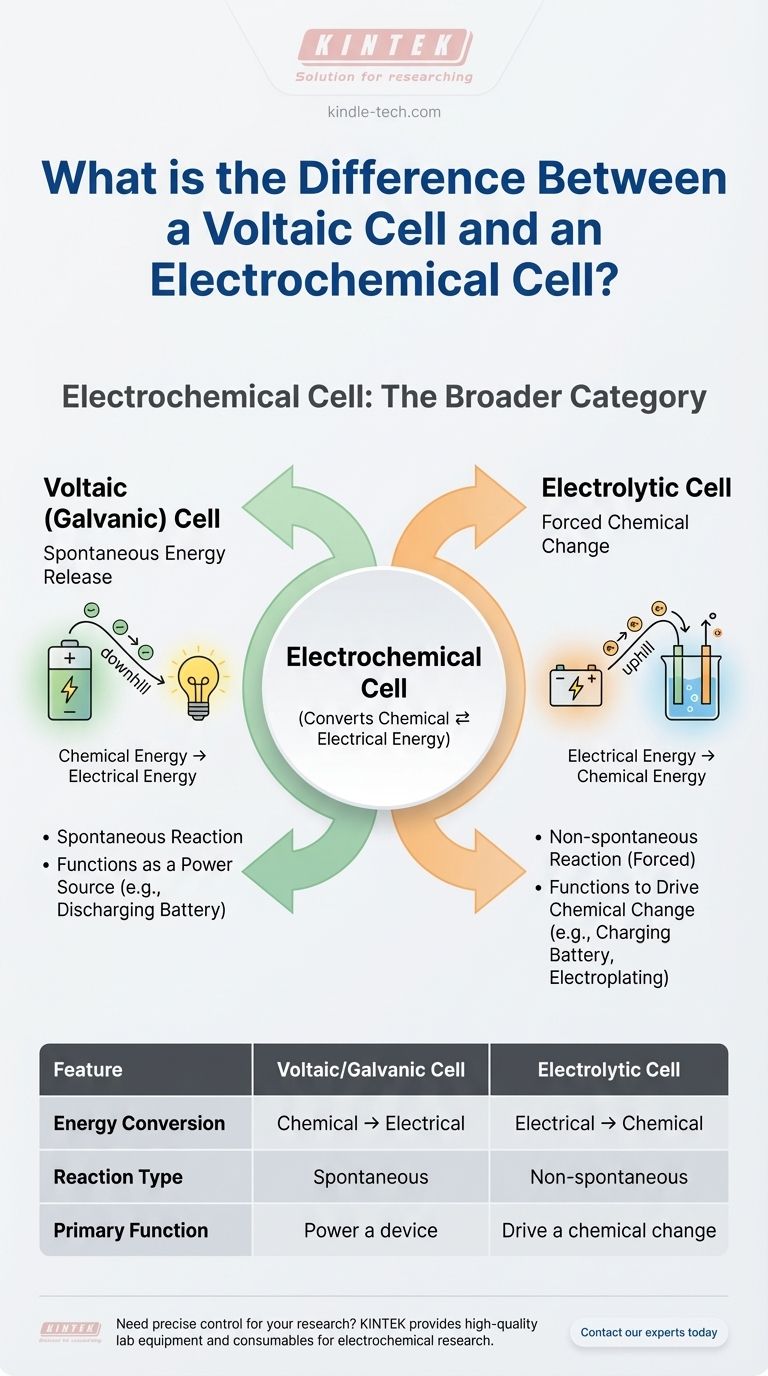
Per essere diretti, una cella voltaica non è diversa da una cella elettrochimica: è un tipo di cella elettrochimica. Il termine "cella elettrochimica" è la categoria ampia per qualsiasi dispositivo che converte energia chimica in energia elettrica o viceversa. Una cella voltaica, nota anche come cella galvanica, è il tipo specifico che genera spontaneamente elettricità da una reazione chimica.
Il malinteso fondamentale deriva dal trattare questi termini come scelte parallele. Invece, pensala come una gerarchia: "Cella Elettrochimica" è il nome della famiglia, e ha due figli: la Cella Voltaica (che produce energia) e la Cella Elettrolitica (che consuma energia).

I due percorsi dell'elettrochimica
Una cella elettrochimica è fondamentalmente un ponte tra il mondo chimico e quello elettrico. Tutte queste celle condividono componenti di base: due elettrodi (un anodo e un catodo) e un elettrolita che consente agli ioni di muoversi tra di loro.
La differenza cruciale risiede nella direzione della conversione energetica.
Tipo 1: La Cella Voltaica (Galvanica) — Rilascio spontaneo di energia
Una cella voltaica sfrutta una reazione chimica spontanea per produrre energia elettrica.
Pensala come uno scivolo controllato. Le sostanze chimiche sono naturalmente "in discesa" in termini di energia, e la cella voltaica fornisce un percorso affinché tale energia venga rilasciata come corrente elettrica utile.
Questo è il principio alla base di una comune batteria. Le reazioni chimiche all'interno di una batteria AA vogliono avvenire da sole, e quando si completa il circuito, la cella incanala il flusso risultante di elettroni per alimentare il dispositivo.
Tipo 2: La Cella Elettrolitica — Modifica chimica forzata
Una cella elettrolitica fa esattamente l'opposto. Utilizza una fonte esterna di energia elettrica per forzare una reazione chimica che non avverrebbe da sola.
Questo è il percorso "in salita". Si sta spingendo energia nel sistema per creare uno stato chimico meno stabile.
Esempi classici includono l'uso dell'elettricità per l'elettrolisi (come la scissione dell'acqua in idrogeno e ossigeno) o la ricarica di una batteria. Quando carichi il telefono, stai facendo funzionare la sua batteria come una cella elettrolitica, invertendo le reazioni chimiche che si sono verificate quando stava alimentando il dispositivo.
Comprendere le differenze critiche
La distinzione tra questi due tipi di celle è il concetto più importante nell'elettrochimica di base. La direzione del flusso di energia determina l'intera funzione della cella.
Conversione energetica
Una cella voltaica converte l'energia chimica in energia elettrica. È una fonte di energia.
Una cella elettrolitica converte l'energia elettrica in energia chimica. È un consumatore di energia.
Spontaneità della reazione
La reazione redox in una cella voltaica è spontanea. Avviene senza intervento esterno una volta che il circuito è completo.
La reazione redox in una cella elettrolitica è non spontanea. Richiede una fonte di alimentazione esterna (come una batteria o un alimentatore CC) per procedere.
Funzione pratica
La funzione di una cella voltaica è alimentare qualcosa. Pensa a qualsiasi batteria standard non ricaricabile.
La funzione di una cella elettrolitica è produrre un cambiamento chimico. Pensa alla galvanostegia dei metalli o alla ricarica di una batteria ricaricabile.
Come classificare correttamente la tua cella
Per applicare questa conoscenza, chiediti semplicemente se la cella sta producendo energia o consumandola per guidare una reazione.
- Se il tuo obiettivo principale è descrivere qualsiasi dispositivo che interconverte energia chimica ed elettrica: Usa il termine generico cella elettrochimica.
- Se stai descrivendo specificamente una batteria che si sta scaricando per alimentare un dispositivo: Usa i termini specifici cella voltaica o cella galvanica.
- Se stai descrivendo specificamente un processo che utilizza l'elettricità per forzare una reazione (come la ricarica di una batteria o l'elettrolisi): Usa il termine specifico cella elettrolitica.
Comprendendo questa semplice classificazione, puoi descrivere qualsiasi processo elettrochimico con precisione e chiarezza.
Tabella riassuntiva:
| Caratteristica | Cella Voltaica/Galvanica | Cella Elettrolitica |
|---|---|---|
| Conversione Energetica | Chimica → Elettrica | Elettrica → Chimica |
| Tipo di Reazione | Spontanea | Non spontanea (Forzata) |
| Funzione Principale | Alimentare un dispositivo (es. batteria) | Guidare un cambiamento chimico (es. galvanostegia) |
Hai bisogno di un controllo preciso sui tuoi processi elettrochimici? KINTEK è specializzata in attrezzature da laboratorio e materiali di consumo di alta qualità per tutte le tue esigenze di ricerca e sviluppo elettrochimico. Sia che tu stia lavorando con celle voltaiche, celle elettrolitiche o qualsiasi altra applicazione di laboratorio, le nostre soluzioni garantiscono precisione e affidabilità. Contatta oggi i nostri esperti per trovare l'attrezzatura perfetta per il tuo laboratorio!
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrolitica in PTFE Cella Elettrochimica Resistente alla Corrosione Sigillata e Non Sigillata
Domande frequenti
- Quali sono i volumi tipici e le configurazioni di apertura per una cella elettrolitica a doppio strato a bagno d'acqua? Ottimizza la tua configurazione elettrochimica
- Quali sono le caratteristiche chiave di una cella elettrolitica a bagno d'acqua a doppio strato? Ottieni un controllo preciso della temperatura per i tuoi esperimenti
- Qual è la struttura di una cella elettrolitica a membrana scambiabile di tipo H? Una guida alla separazione elettrochimica precisa
- Quali caratteristiche ottiche presenta la cella elettrolitica di tipo H? Finestrini di quarzo di precisione per la fotoelettrochimica
- Cos'è una cella di tipo H? Una guida alle celle elettrochimiche divise per esperimenti accurati



















