In qualsiasi sistema elettrochimico, le due precauzioni più critiche sono garantire la corretta polarità degli elettrodi e selezionare l'elettrolita appropriato per la tua reazione. La polarità determina quale processo chimico avviene dove, mentre l'elettrolita fornisce il mezzo necessario per quel processo. Sbagliare uno dei due può portare a esperimenti falliti, apparecchiature danneggiate o significativi rischi per la sicurezza.
La polarità dei tuoi elettrodi definisce la direzione della reazione chimica, e l'elettrolita ne determina la fattibilità. Un'errata corrispondenza di uno dei due altererà, inibirà o corromperà attivamente il processo elettrochimico desiderato.
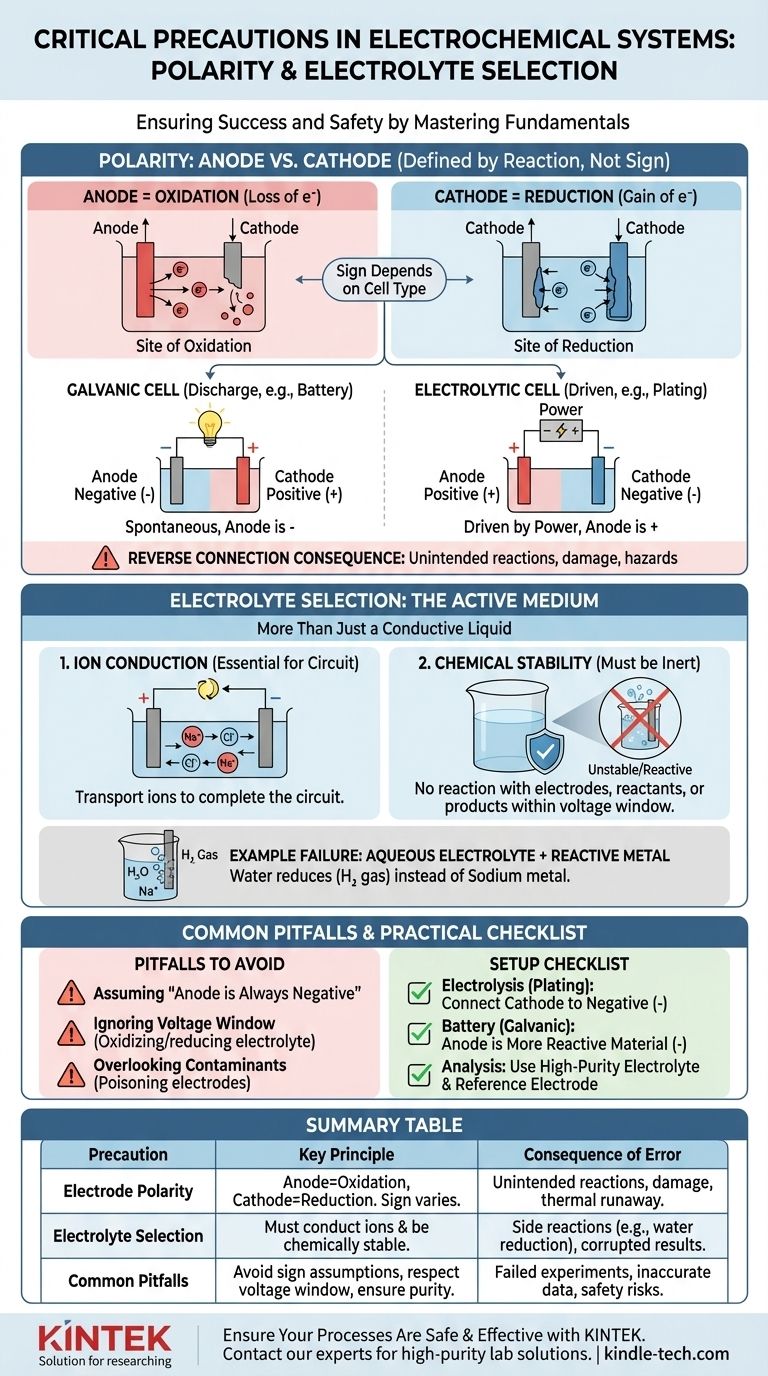
Il ruolo critico della polarità: Anodo vs. Catodo
Identificare correttamente il tuo anodo e catodo è il primo passo per costruire una cella elettrochimica funzionale e prevedibile. Questo va oltre la semplice etichettatura dei terminali come "positivo" o "negativo".
Cosa significa veramente "Polarità"
I termini anodo e catodo sono definiti dal tipo di reazione, non dalla loro carica.
- L'Anodo è sempre il sito di Ossidazione (perdita di elettroni).
- Il Catodo è sempre il sito di Riduzione (guadagno di elettroni).
La confusione nasce perché il segno (+ o -) di questi elettrodi dipende dal tipo di cella. In una batteria che si scarica (una cella galvanica), l'anodo è il terminale negativo. In una configurazione di elettrolisi (una cella elettrolitica), l'anodo è collegato al terminale positivo dell'alimentatore.
La conseguenza di una connessione inversa
Collegare gli elettrodi in modo errato forza le reazioni chimiche a procedere al contrario o in un modo non intenzionale.
In una cella elettrolitica (ad esempio, galvanoplastica), una connessione inversa significa che rimuoverai materiale dall'elettrodo che intendevi placcare e depositerai materiale sul tuo anodo sorgente, distruggendo entrambi.
In una batteria ricaricabile, la ricarica con polarità invertita può causare danni irreversibili alle strutture degli elettrodi, portando a una perdita permanente di capacità, cortocircuiti interni e un potenziale pericoloso runaway termico.
Selezione dell'elettrolita: Più di un semplice liquido conduttivo
L'elettrolita non è un componente passivo; è una parte attiva e critica del sistema elettrochimico. Le sue proprietà dettano quali reazioni sono persino possibili.
La funzione primaria: Conduzione ionica
Il compito più basilare dell'elettrolita è trasportare gli ioni tra anodo e catodo, completando il circuito elettrico. Senza un mezzo per il flusso ionico, l'intera reazione si fermerebbe istantaneamente.
La funzione critica: Stabilità chimica
L'elettrolita e il suo solvente devono essere chimicamente inerti nelle condizioni operative. Non dovrebbero reagire con gli elettrodi, i reagenti o i prodotti della tua reazione primaria. Questa è la fonte delle "reazioni secondarie indesiderate" menzionate nei protocolli di sicurezza.
Esempio: Perché gli elettroliti acquosi falliscono per i metalli reattivi
Immagina di provare a produrre sodio metallico elettrolizzando una soluzione di cloruro di sodio (NaCl) in acqua.
Potresti aspettarti che gli ioni sodio (Na+) si muovano verso il catodo, guadagnino un elettrone e formino sodio metallico. Tuttavia, l'acqua (H₂O) è anche presente ed è molto più facile da ridurre rispetto agli ioni sodio. Di conseguenza, produrrai idrogeno gassoso al catodo e non si formerà sodio metallico. La scelta dell'elettrolita ha reso impossibile la reazione desiderata.
Comprendere i compromessi e le insidie comuni
Evitare errori semplici richiede la comprensione dei principi sottostanti che governano tutte le celle elettrochimiche.
Insidia 1: Supporre che "l'anodo sia negativo"
L'errore più comune è l'errata identificazione di anodo e catodo. Ricorda sempre di definirli in base alla reazione (ossidazione/riduzione), non in base a un segno fisso. Determina se la tua cella è galvanica (spontanea) o elettrolitica (azionato da energia esterna) per assegnare il segno corretto.
Insidia 2: Ignorare la finestra di tensione dell'elettrolita
Ogni elettrolita ha una finestra di potenziale di stabilità. Se applichi una tensione che supera questa finestra, inizierai a ossidare o ridurre l'elettrolita stesso, non il tuo obiettivo. Questo consuma energia, crea impurità e interrompe la reazione desiderata.
Insidia 3: Trascurare i contaminanti
Anche tracce di impurità in un elettrolita possono avere un impatto enorme. I contaminanti possono depositarsi sulla superficie di un elettrodo, "avvelenandolo" e impedendo la reazione desiderata, oppure possono agire come catalizzatori per reazioni secondarie indesiderate che corrompono i tuoi risultati.
Una checklist pratica per la tua configurazione
Usa queste linee guida per assicurarti che la tua configurazione sperimentale sia corretta fin dall'inizio.
- Se il tuo obiettivo principale è l'elettrolisi (ad esempio, placcatura, raffinazione): Collega l'elettrodo che vuoi placcare (il catodo) al terminale negativo dell'alimentatore e il materiale sorgente (l'anodo) al terminale positivo.
- Se il tuo obiettivo principale è costruire una batteria (una cella galvanica): Il materiale più reattivo chimicamente che si ossida è il tuo anodo (terminale negativo), e il materiale meno reattivo è il tuo catodo (terminale positivo).
- Se il tuo obiettivo principale è un'analisi elettrochimica accurata: Utilizza un elettrolita ad alta purezza, spesso degassato, per prevenire reazioni secondarie e conferma la tua configurazione di polarità rispetto a uno standard noto o a un elettrodo di riferimento.
Trattando la polarità e la scelta dell'elettrolita come parametri di progettazione fondamentali, passi dal semplice seguire le istruzioni all'ingegnerizzazione vera e propria del risultato elettrochimico desiderato.

Tabella riassuntiva:
| Precauzione | Principio chiave | Conseguenza dell'errore |
|---|---|---|
| Polarità dell'elettrodo | Anodo = Sito di ossidazione; Catodo = Sito di riduzione. Il segno dipende dal tipo di cella (galvanica vs. elettrolitica). | La connessione inversa causa reazioni indesiderate (ad esempio, rimozione invece di placcatura), danni alle apparecchiature o runaway termico. |
| Selezione dell'elettrolita | Deve condurre ioni e rimanere chimicamente stabile nelle condizioni operative (finestra di tensione). | L'elettrolita sbagliato abilita reazioni secondarie (ad esempio, riduzione dell'acqua invece di deposizione di sodio), corrompe i risultati e spreca energia. |
| Insidie comuni | Supporre 'l'anodo è sempre negativo'; ignorare la finestra di tensione dell'elettrolita; trascurare i contaminanti. | Esperimenti falliti, dati imprecisi e rischi per la sicurezza a causa di processi chimici non intenzionali. |
Assicura che i tuoi processi elettrochimici siano sicuri ed efficaci con KINTEK
Stai preparando un progetto di elettrolisi, placcatura o sviluppo di batterie? La corretta polarità degli elettrodi e la selezione dell'elettrolita sono non negoziabili per ottenere risultati accurati e mantenere la sicurezza. In KINTEK, siamo specializzati nella fornitura di apparecchiature e materiali di consumo da laboratorio ad alta purezza, inclusi celle elettrochimiche, elettroliti puri e alimentatori affidabili, per supportare le esigenze uniche del tuo laboratorio.
Lasciaci aiutarti a evitare errori e pericoli costosi. Contatta i nostri esperti oggi per discutere la tua specifica applicazione e scoprire come le soluzioni KINTEK possono migliorare il tuo flusso di lavoro elettrochimico.
Guida Visiva
Prodotti correlati
- Elettrodo a disco rotante in platino per applicazioni elettrochimiche
- Elettrodo a disco d'oro
- Elettrodo di riferimento al solfato di rame per uso di laboratorio
- Elettrodo Ausiliario in Platino per Uso di Laboratorio
- Alette in Nichel-Alluminio per Batterie al Litio Soft Pack
Domande frequenti
- Qual è la differenza tra RDE e RRDE? Sblocca l'analisi avanzata delle reazioni elettrochimiche
- Qual è l'applicazione dell'RRDE? Sblocca approfondimenti quantitativi su catalizzatori e reazioni
- Qual è il ruolo comune di un elettrodo a disco di platino? Una guida al suo uso primario come elettrodo di lavoro
- Quali sono le caratteristiche prestazionali degli elettrodi in filo/barra di platino? Stabilità impareggiabile per il tuo laboratorio
- Cos'è il metodo dell'elettrodo a disco ad anello rotante? Sblocca l'analisi delle reazioni in tempo reale



















