Introduzione ai materiali di consumo elettrochimici
Indice dei contenuti
I materiali di consumo elettrochimici svolgono un ruolo cruciale negli esperimenti e nelle applicazioni di elettrochimica. Essi comprendono gli elettrodi, che facilitano il trasferimento degli elettroni, e gli elettroliti, che forniscono gli ioni per le reazioni elettrochimiche. Questa guida completa esplora il mondo dei materiali di consumo elettrochimici, comprendendo diversi tipi di elettrodi (di lavoro, ausiliari e di riferimento) e di elettroliti. Approfondisce i fattori da considerare nella scelta dei materiali per gli esperimenti o le applicazioni elettrochimiche, per garantire risultati accurati e di successo.
Tipi di elettrodi
Elettrodo di lavoro
L'elettrodo di lavoro (WE) è l'elettrodo in cui avviene la reazione elettrochimica di interesse. In genere è costituito da un metallo nobile, come l'oro, il platino o il carbonio, che sono resistenti alla corrosione e hanno un'elevata conducibilità elettrica. La scelta del materiale per il WE dipende dall'applicazione specifica. Ad esempio, l'oro è spesso utilizzato per le applicazioni di rilevamento elettrochimico, mentre il platino è comunemente utilizzato per le applicazioni delle celle a combustibile.
Elettrodo ausiliario
L'elettrodo ausiliario (AE) viene utilizzato per completare il circuito elettrico in una cella elettrochimica. Fornisce un percorso per il flusso di corrente tra l'elettrodo WE e l'elettrodo di riferimento. L'elettrodo ausiliario è in genere costituito da un metallo che non si ossida o riduce facilmente, come il platino, il carbonio, il rame o l'acciaio inossidabile. La scelta del materiale dell'AE non è così critica come quella del WE, ma deve essere compatibile con l'elettrolita e il materiale del WE.
Elettrodo di riferimento
L'elettrodo di riferimento (RE) viene utilizzato per fornire un potenziale di riferimento stabile e riproducibile rispetto al quale misurare il potenziale del WE. L'elettrodo di riferimento è in genere costituito da un metallo facilmente ossidabile o riducibile, come l'argento, il calomelano o il mercurio. La scelta del materiale per il RE dipende dall'applicazione specifica. Ad esempio, le RE in argento/cloruro d'argento (Ag/AgCl) sono comunemente utilizzate in soluzioni acquose, mentre le RE in calomelano sono spesso utilizzate in soluzioni non acquose.

Elettroliti e loro proprietà
Gli elettroliti sono sostanze che contengono ioni mobili quando sono fusi o in soluzione acquosa, consentendo loro di condurre l'elettricità. Svolgono un ruolo fondamentale nei processi elettrochimici, come nelle batterie, nelle celle a combustibile e nella galvanotecnica.
Tipi di elettroliti
Gli elettroliti possono essere classificati in tre tipi principali in base al loro stato fisico:
-
Elettroliti liquidi: Sono il tipo più comune di elettroliti e sono tipicamente soluzioni di sali, acidi o basi in un solvente come l'acqua. Ne sono un esempio il cloruro di sodio (NaCl) disciolto in acqua, l'acido solforico (H2SO4) disciolto in acqua e l'idrossido di potassio (KOH) disciolto in acqua.
-
Elettroliti solidi: Gli elettroliti solidi sono tipicamente composti ionici che conducono l'elettricità allo stato solido. Sono spesso utilizzati nelle batterie allo stato solido e nelle celle a combustibile. Ne sono un esempio le ceramiche conduttrici di ioni di litio e gli elettroliti polimerici.
-
Elettroliti fusi: Gli elettroliti fusi sono sali che vengono fusi ad alte temperature, consentendo loro di condurre l'elettricità. Sono utilizzati in applicazioni ad alta temperatura, come i reattori a sali fusi e alcuni tipi di batterie. Ne sono un esempio il cloruro di sodio fuso (NaCl) e il cloruro di litio fuso (LiCl).
Fattori da considerare nella scelta dell'elettrolita
Quando si sceglie un elettrolita per una particolare applicazione, si devono considerare diversi fattori:
-
Conduttività: La conduttività di un elettrolita misura la sua capacità di condurre elettricità. È influenzata dalla concentrazione di ioni nell'elettrolita e dalla mobilità di tali ioni.
-
Stabilità: L'elettrolita deve essere stabile nelle condizioni operative della cella elettrochimica. Non deve decomporsi o reagire con gli elettrodi o altri componenti della cella.
-
Compatibilità con gli elettrodi: L'elettrolita deve essere compatibile con gli elettrodi utilizzati nella cella elettrochimica. Non deve corrodere o dissolvere gli elettrodi.
-
Costo: Anche il costo dell'elettrolita è una considerazione importante, soprattutto per le applicazioni su larga scala.
Applicazioni degli elettroliti
Gli elettroliti hanno un'ampia gamma di applicazioni, tra cui:
-
Batterie: Gli elettroliti sono utilizzati nelle batterie per fornire un mezzo per il trasporto di ioni tra gli elettrodi positivi e negativi.
-
Celle a combustibile: Gli elettroliti sono utilizzati nelle celle a combustibile per facilitare le reazioni elettrochimiche che generano elettricità.
-
Galvanotecnica: Gli elettroliti sono utilizzati nella galvanotecnica per depositare un sottile strato di metallo su una superficie.
-
Trattamento chimico: Gli elettroliti sono utilizzati in vari processi chimici, come la produzione di cloro e idrossido di sodio.

Considerazioni sulla selezione dei materiali
La selezione dei materiali per gli elettrodi e gli elettroliti nei sistemi elettrochimici è una fase critica che ha un impatto significativo sulle prestazioni, l'efficienza e l'economicità del processo complessivo. Nella scelta dei materiali appropriati si devono considerare diversi fattori, tra cui le proprietà intrinseche, la reattività, l'inerzia, la resistenza alla corrosione e il costo.
Proprietà desiderabili per i materiali anodici, catodici ed elettrolitici
Materiali anodici:
- Efficiente agente riducente: Il materiale anodico deve possedere forti capacità riducenti per facilitare le reazioni elettrochimiche desiderate.
- Alto rendimento coulombiano: Deve presentare un'elevata efficienza coulombiana, garantendo un utilizzo efficiente del materiale attivo e riducendo al minimo la perdita di capacità.
- Buona conducibilità: Un'elevata conducibilità elettrica è essenziale per un efficiente trasferimento di carica e riduce al minimo le perdite di energia dovute alla resistenza ohmica.
- Stabilità: Il materiale anodico deve essere chimicamente ed elettrochimicamente stabile nelle condizioni operative per evitare il degrado e mantenere le prestazioni a lungo termine.
- Facilità di fabbricazione: Il materiale deve essere facilmente lavorabile e fabbricabile nelle forme e dimensioni desiderate, consentendo una produzione economicamente vantaggiosa.
- Basso costo: Un materiale anodico economicamente conveniente è fondamentale per le applicazioni su larga scala, soprattutto in ambito industriale.
I materiali anodici comunemente utilizzati includono metalli come lo zinco, il litio e la grafite, selezionati in base alle loro proprietà specifiche e all'idoneità per l'applicazione prevista.
Materiali catodici:
- Agente ossidante efficiente: Il materiale catodico deve possedere forti capacità ossidanti per facilitare le reazioni elettrochimiche desiderate.
- Stabilità nell'elettrolita: Deve essere chimicamente ed elettrochimicamente stabile a contatto con l'elettrolita per evitare la degradazione e mantenere le prestazioni a lungo termine.
- Tensione utile di lavoro: Il materiale catodico deve presentare un intervallo di tensione di lavoro adeguato che si allinei con le condizioni operative desiderate e garantisca un efficiente accumulo o conversione di energia.
- Facilità di fabbricazione: Analogamente ai materiali anodici, il materiale catodico deve essere facilmente lavorabile e fabbricabile nelle forme e dimensioni desiderate per una produzione economicamente vantaggiosa.
- Basso costo: La redditività economica è una considerazione fondamentale per i materiali catodici, soprattutto nelle applicazioni su larga scala.
Tra i materiali catodici comunemente utilizzati vi sono gli ossidi metallici, come l'ossido di litio e cobalto (LCO), l'ossido di nichel manganese e cobalto (NMC) e il fosfato di ferro e litio (LFP), scelti in base alle loro proprietà specifiche e all'idoneità per l'applicazione prevista.
Materiali elettrolitici:
- Conduttività ionica: L'elettrolita deve presentare un'elevata conducibilità ionica per favorire un trasporto efficiente degli ioni e ridurre al minimo la resistenza al flusso di carica.
- Stabilità chimica ed elettrochimica: L'elettrolita deve essere chimicamente ed elettrochimicamente stabile nelle condizioni operative per evitare la decomposizione e mantenere le prestazioni a lungo termine.
- Ampia finestra elettrochimica: L'elettrolita deve possedere un'ampia finestra elettrochimica, che consenta un'ampia gamma di tensioni operative senza subire decomposizioni o altre reazioni indesiderate.
- Compatibilità con gli elettrodi: L'elettrolita deve essere compatibile con i materiali dell'anodo e del catodo, garantendo interfacce stabili e prevenendo reazioni indesiderate.
- Non tossico e rispettoso dell'ambiente: L'elettrolita deve essere non tossico e rispettoso dell'ambiente, per ridurre al minimo i rischi potenziali e facilitare la manipolazione e lo smaltimento in sicurezza.
Gli elettroliti comunemente utilizzati comprendono soluzioni acquose, solventi organici, liquidi ionici ed elettroliti allo stato solido, selezionati in base alle loro proprietà specifiche e all'idoneità per l'applicazione prevista.
Fattori che influenzano la selezione dei materiali
Oltre alle proprietà desiderabili sopra menzionate, diversi altri fattori influenzano la scelta dei materiali per elettrodi ed elettroliti:
- Reattività: La reattività dei materiali deve essere attentamente considerata per garantire la compatibilità con le reazioni elettrochimiche previste e prevenire reazioni collaterali indesiderate.
- Inerzia: I materiali devono essere inerti nei confronti degli altri componenti del sistema elettrochimico, come l'elettrolita e i collettori di corrente, per ridurre al minimo la corrosione e mantenere la stabilità a lungo termine.
- Resistenza alla corrosione: I materiali devono presentare una buona resistenza alla corrosione nelle condizioni operative per prevenire il degrado e garantire prestazioni affidabili nel tempo.
- Costo: Il costo dei materiali è un fattore significativo, soprattutto per le applicazioni su larga scala, e deve essere bilanciato rispetto alle prestazioni desiderate e all'efficacia dei costi a lungo termine.
Considerando attentamente questi fattori e selezionando i materiali appropriati, i ricercatori e gli ingegneri possono ottimizzare le prestazioni, l'efficienza e l'economicità dei sistemi elettrochimici per varie applicazioni.
Applicazioni dei materiali di consumo elettrochimici
I materiali di consumo elettrochimici sono materiali e componenti specializzati utilizzati in vari settori per condurre esperimenti e analisi elettrochimiche. Svolgono un ruolo cruciale nei processi elettrochimici, consentendo di studiare le reazioni chimiche e il comportamento delle sostanze nelle soluzioni.
Immagazzinamento dell'energia
I consumabili elettrochimici trovano ampie applicazioni nei sistemi di accumulo di energia, tra cui batterie, celle a combustibile e supercondensatori. Questi materiali di consumo sono componenti essenziali di questi dispositivi, in quanto forniscono le reazioni elettrochimiche necessarie per l'accumulo e il rilascio di energia.
-
Batterie: I materiali di consumo elettrochimici sono utilizzati nelle batterie per facilitare le reazioni elettrochimiche che generano elettricità. I tipi di batterie più comuni sono quelle al piombo, agli ioni di litio e al nichel-cadmio. Questi materiali di consumo comprendono elettrodi, separatori ed elettroliti.
-
Celle a combustibile: Le celle a combustibile utilizzano reazioni elettrochimiche per generare elettricità da combustibili come l'idrogeno o il metanolo. I materiali di consumo elettrochimici delle celle a combustibile comprendono elettrodi, elettroliti e catalizzatori.
-
Supercondensatori: I supercondensatori immagazzinano energia elettrica attraverso l'attrazione elettrostatica. I materiali elettrochimici utilizzati nei supercondensatori comprendono elettrodi ed elettroliti.
Galvanotecnica
La galvanoplastica è un processo che utilizza reazioni elettrochimiche per rivestire una superficie metallica con un sottile strato di un altro metallo. Questo rivestimento può fornire protezione contro la corrosione, aumentare la conduttività elettrica o migliorare l'aspetto del metallo. I materiali di consumo elettrochimici utilizzati nella galvanotecnica comprendono:
-
Anodi: Gli anodi sono gli elettrodi a carica positiva del processo galvanico. In genere sono costituiti dal metallo che viene depositato sulla superficie.
-
Catodi: I catodi sono gli elettrodi con carica negativa nel processo di galvanizzazione. In genere sono costituiti dal metallo che viene rivestito.
-
Elettroliti: Gli elettroliti sono soluzioni che contengono ioni e consentono il flusso di elettricità tra anodo e catodo.

Studi sulla corrosione
I consumabili elettrochimici sono impiegati negli studi sulla corrosione per analizzare il degrado di metalli e materiali. Questi studi aiutano i ricercatori a comprendere i meccanismi della corrosione e a sviluppare strategie per prevenirla o attenuarla. I materiali di consumo elettrochimici utilizzati negli studi sulla corrosione comprendono:
-
Elettrodi: Gli elettrodi sono utilizzati per misurare il potenziale elettrico e il flusso di corrente negli esperimenti di corrosione.
-
Elettroliti: Gli elettroliti sono soluzioni che contengono ioni e permettono il flusso di elettricità tra gli elettrodi.
-
Celle di corrosione: Le celle di corrosione sono celle elettrochimiche progettate per simulare e studiare i processi di corrosione.
Analisi chimica
I consumabili elettrochimici sono utilizzati in varie tecniche analitiche per determinare la concentrazione o le proprietà di sostanze in soluzione. Queste tecniche includono:
-
Voltammetria ciclica: La voltammetria ciclica è una tecnica elettrochimica che prevede l'oscillazione del potenziale di un elettrodo di lavoro e la misurazione della corrente risultante. Viene utilizzata per studiare il comportamento redox delle sostanze e determinarne le proprietà elettrochimiche.
-
Potenziometria: La potenziometria è una tecnica elettrochimica che prevede la misurazione della differenza di potenziale tra due elettrodi in una soluzione. Viene utilizzata per determinare la concentrazione degli ioni in soluzione e per studiare le reazioni di equilibrio.
-
Amperometria: L'amperometria è una tecnica elettrochimica che prevede la misurazione del flusso di corrente tra due elettrodi in una soluzione. Viene utilizzata per studiare la cinetica delle reazioni elettrochimiche e per determinare la concentrazione delle specie elettroattive in soluzione.
Questi sono solo alcuni esempi delle numerose applicazioni dei materiali di consumo elettrochimici in vari settori industriali e di ricerca. Questi materiali specializzati svolgono un ruolo fondamentale nel far progredire la nostra comprensione dei processi elettrochimici e nel consentire lo sviluppo di nuove tecnologie e prodotti.
Configurazioni a due e a tre elettrodi
Setup a due elettrodi
In una configurazione a due elettrodi, un singolo elettrodo funge sia da elettrodo di lavoro che da controelettrodo. Questa configurazione è comunemente utilizzata in esperimenti elettrochimici semplici, come l'analisi qualitativa e gli studi di corrosione. Il vantaggio principale della configurazione a due elettrodi è la sua semplicità. Tuttavia, presenta diversi svantaggi, tra cui l'impossibilità di controllare il potenziale dell'elettrodo di lavoro e la difficoltà di separare i contributi dell'elettrodo di lavoro e del controelettrodo alla corrente complessiva.
Setup a tre elettrodi
In una configurazione a tre elettrodi, un elettrodo di riferimento dedicato viene utilizzato per controllare il potenziale dell'elettrodo di lavoro. Ciò consente di ottenere misure più accurate e riproducibili. Il controelettrodo serve a completare il circuito e a fornire un percorso per il passaggio della corrente. La configurazione a tre elettrodi è quella più comunemente utilizzata negli esperimenti elettrochimici.
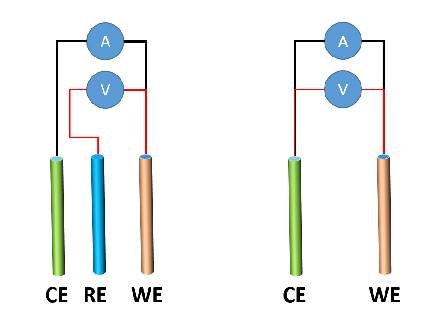
Vantaggi e svantaggi delle configurazioni a due e tre elettrodi
La tabella seguente riassume i vantaggi e gli svantaggi delle configurazioni a due e a tre elettrodi:
| Configurazione | Vantaggi | Svantaggi |
| A due elettrodi | Semplice | Non è possibile controllare il potenziale dell'elettrodo di lavoro | Difficile separare i contributi dell'elettrodo di lavoro e del controelettrodo alla corrente complessiva | A tre elettrodi | Misure più accurate e riproducibili | Più complesso | Richiede un elettrodo di riferimento dedicato |
Quando utilizzare una configurazione a due o a tre elettrodi
La scelta di utilizzare una configurazione a due o a tre elettrodi dipende dall'esperimento specifico da eseguire. In generale, una configurazione a tre elettrodi è preferibile per l'analisi quantitativa e gli studi meccanicistici. Una configurazione a due elettrodi può essere utilizzata per analisi qualitative e studi sulla corrosione.
Applicazioni delle configurazioni a due e tre elettrodi
I setup a due e tre elettrodi sono utilizzati in un'ampia gamma di esperimenti elettrochimici. Alcune delle applicazioni più comuni sono:
- Voltammetria ciclica: Questa tecnica viene utilizzata per studiare le proprietà elettrochimiche di un materiale facendo oscillare il potenziale dell'elettrodo di lavoro tra due valori.
- Voltammetria lineare: Questa tecnica viene utilizzata per studiare le proprietà elettrochimiche di un materiale facendo scorrere linearmente il potenziale dell'elettrodo di lavoro da un valore all'altro.
- Cronoamperometria: Questa tecnica viene utilizzata per studiare la risposta corrente-tempo di un materiale a una variazione graduale del potenziale.
- Potenziometria: Questa tecnica viene utilizzata per misurare il potenziale di un materiale in condizioni di equilibrio.
Conclusione
Le configurazioni a due e tre elettrodi sono strumenti essenziali per gli esperimenti elettrochimici. La scelta della configurazione da utilizzare dipende dall'esperimento specifico da eseguire.
Conclusione
In conclusione, i materiali di consumo elettrochimici svolgono un ruolo cruciale per il successo degli esperimenti e delle applicazioni elettrochimiche. La scelta dei materiali elettrodici e degli elettroliti deve essere attentamente valutata in base a vari fattori, tra cui la reattività, l'inerzia, la resistenza alla corrosione e la compatibilità con l'applicazione specifica. La comprensione dei diversi tipi di elettrodi e di elettroliti, nonché delle considerazioni sulla scelta dei materiali, è essenziale per i ricercatori e gli operatori nel campo dell'elettrochimica. Selezionando i materiali di consumo elettrochimici appropriati, gli scienziati possono ottenere risultati accurati e affidabili, che portano a progressi nella ricerca e negli sviluppi tecnologici.
Prodotti correlati
- Materiale per lucidatura elettrodi per esperimenti elettrochimici
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Elettrodo Elettrochimico a Disco Metallico
- Elettrodo di riferimento al solfato di rame per uso di laboratorio
- Elettrodo a foglio d'oro per elettrochimica Elettrodo d'oro
Articoli correlati
- Come scegliere il giusto elettrodo elettrochimico
- Elettrodi elettrochimici nell'analisi chimica
- Capire l'elettrodeposizione con gli elettrodi elettrochimici
- Tecniche avanzate di valutazione dei rivestimenti tramite celle elettrolitiche
- Guida completa all'elettrodo a disco rotante (RDE) negli studi elettrochimici


















