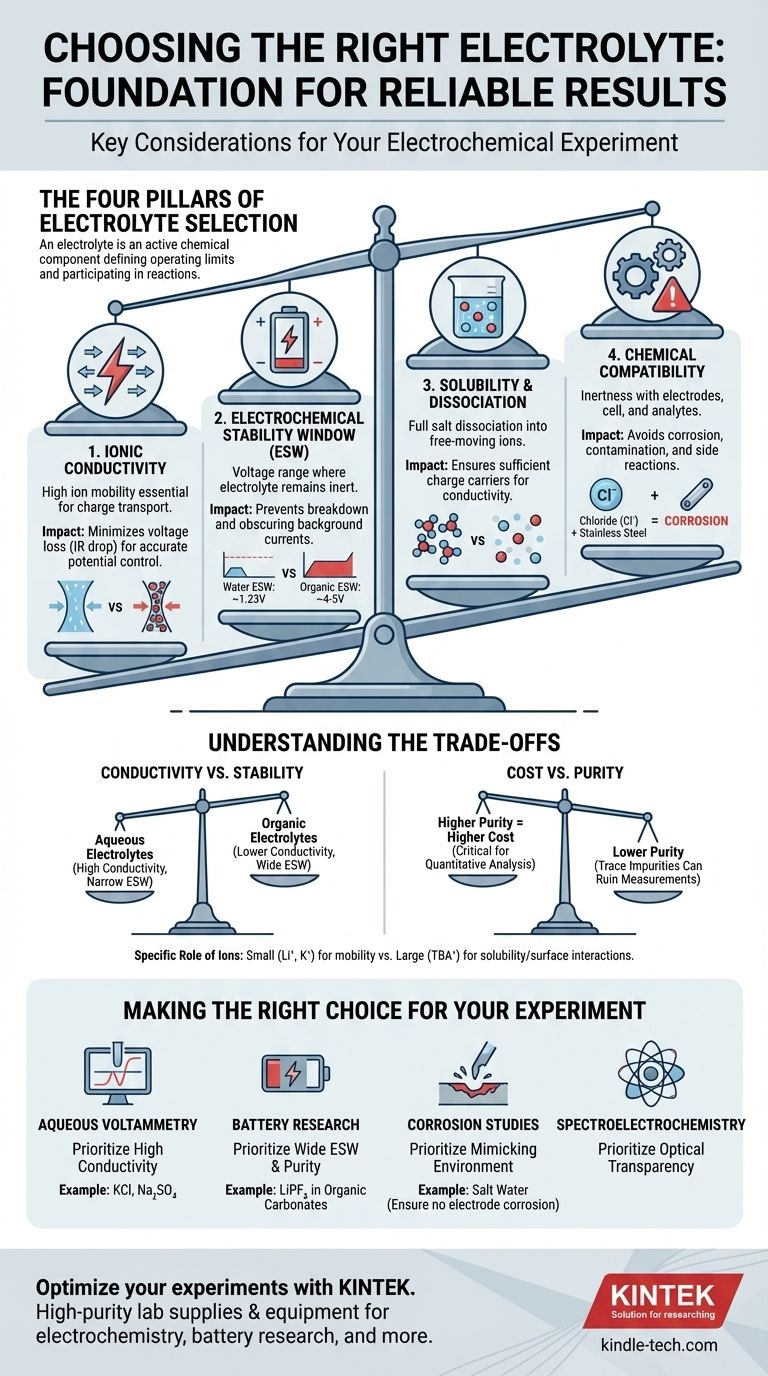
Quando si seleziona un elettrolita per un esperimento, è necessario valutare quattro proprietà chiave: la sua conducibilità ionica, la sua finestra di stabilità elettrochimica, la sua solubilità nel solvente scelto e la sua compatibilità chimica con l'intero sistema sperimentale. Questi fattori determinano collettivamente se l'elettrolita supporterà la reazione che si desidera studiare o introdurrà artefatti che invalidano i risultati.
Il punto centrale è che un elettrolita non è semplicemente un conduttore passivo. È un componente chimico attivo che definisce i limiti operativi della cella elettrochimica e può partecipare direttamente a reazioni secondarie, rendendo la sua attenta selezione fondamentale per ottenere dati affidabili e significativi.

I Quattro Pilastri della Selezione dell'Elettrolita
Scegliere l'elettrolita giusto è un processo di bilanciamento dei requisiti. L'elettrolita ideale facilita la reazione desiderata rimanendo completamente inerte e invisibile alla misurazione. Possiamo suddividere questo processo di selezione in quattro considerazioni critiche.
Pilastro 1: Conducibilità Ionica
Il compito principale di un elettrolita è trasportare la carica tra gli elettrodi. È essenziale un'elevata conducibilità ionica per questo scopo.
Una scarsa conducibilità porta a una grande caduta ohmica (o caduta IR), che è una perdita di tensione attraverso l'elettrolita. Ciò significa che il potenziale applicato alla cella non è il potenziale effettivamente percepito sulla superficie dell'elettrodo, portando a misurazioni imprecise dei potenziali di reazione.
Pensa all'elettrolita come a un'autostrada per gli ioni. Un elettrolita ad alta conducibilità è un'autostrada larga e sgombra, mentre uno a bassa conducibilità è una strada laterale congestionata, che rallenta tutto e spreca energia.
Pilastro 2: Finestra di Stabilità Elettrochimica (ESW)
La finestra di stabilità elettrochimica (ESW) è l'intervallo di potenziali in cui l'elettrolita stesso — sia il sale che il solvente — non viene ossidato o ridotto.
Operare al di fuori di questa finestra è un fallimento critico. Se si applica un potenziale troppo positivo o troppo negativo, si inizierà a decomporre l'elettrolita invece di studiare l'analita. Ciò crea grandi correnti di fondo che possono oscurare completamente il segnale che si sta cercando di misurare.
Ad esempio, l'ESW dell'acqua è di soli circa 1,23 V. Per esperimenti che richiedono potenziali più elevati, come nella ricerca sulle batterie agli ioni di litio, è necessario passare a solventi organici e sali specifici (ad esempio, LiPF₆ in carbonati organici) che offrono una finestra molto più ampia (~4-5 V).
Pilastro 3: Solubilità e Dissociazione
Affinché un elettrolita funzioni, il sale non deve solo dissolversi, ma deve anche dissociarsi completamente in cationi e anioni liberi di muoversi nel solvente.
Se il sale ha una scarsa solubilità o forma stretti "coppie ioniche" invece di separarsi, il numero di portatori di carica disponibili diminuisce drasticamente. Ciò riduce direttamente la conducibilità ionica, compromettendo la funzione principale dell'elettrolita.
Assicurati sempre che il sale scelto sia altamente solubile nel solvente selezionato alla concentrazione che intendi utilizzare (tipicamente da 0,1 M a 1,0 M per esperimenti su scala di laboratorio).
Pilastro 4: Compatibilità Chimica
L'elettrolita deve essere chimicamente inerte rispetto a ogni componente della cella: l'elettrodo di lavoro, l'elettrodo di contro, l'elettrodo di riferimento e il corpo della cella stessa.
Un errore comune è utilizzare un elettrolita contenente ioni cloruro (come KCl) con componenti in acciaio inossidabile. Il cloruro è altamente corrosivo per l'acciaio inossidabile e causerà vaiolatura e rilascio di ioni metallici nella soluzione, contaminando l'esperimento.
Allo stesso modo, gli ioni dell'elettrolita non dovrebbero reagire o adsorbire troppo fortemente sulla superficie dell'elettrodo, a meno che tale interazione non sia il fenomeno specifico che si sta studiando.
Comprendere i Compromessi
Non esiste un unico elettrolita "migliore"; ogni scelta comporta il bilanciamento di fattori in competizione. Comprendere questi compromessi è il segno di un ricercatore esperto.
Conducibilità vs. Stabilità
Gli elettroliti acquosi (ad esempio, NaCl in acqua) offrono un'eccellente conducibilità ionica ma hanno una finestra di stabilità elettrochimica molto ristretta. Al contrario, molti elettroliti a base di solventi organici offrono un'ampia finestra di stabilità ma spesso soffrono di una conducibilità inferiore. La tua scelta dipende dal fatto che il tuo esperimento sia limitato dalla tensione o dall'efficienza di corrente.
Costo vs. Purezza
I sali e i solventi ad alta purezza, di "grado batteria" o di "grado elettrochimico" sono significativamente più costosi. Tuttavia, le impurità in tracce (come l'acqua in un elettrolita non acquoso o gli ioni alogenuri) possono introdurre segnali elettrochimici indesiderati e rovinare misurazioni sensibili. Per dimostrazioni semplici, un grado inferiore può essere sufficiente, ma per l'analisi quantitativa, investire nella purezza è fondamentale.
Il Ruolo Specifico degli Ioni
Non tutti gli ioni sono creati uguali. Gli ioni piccoli e mobili come il litio (Li⁺) o il potassio (K⁺) sono eccellenti portatori di carica. Tuttavia, gli ioni organici grandi come il tetrabutilammonio (TBA⁺) sono spesso utilizzati per aumentare la solubilità degli analiti apolari in solventi polari e possono aiutare a minimizzare le interazioni indesiderate sulla superficie dell'elettrodo.
Fare la Scelta Giusta per il Tuo Esperimento
Il tuo obiettivo specifico detta quali proprietà privilegiare.
- Se il tuo obiettivo principale è la voltammetria acquosa standard: Dai priorità all'elevata conducibilità e utilizza un sale semplice e inerte come cloruro di potassio (KCl) o solfato di sodio (Na₂SO₄), assicurandoti che il tuo intervallo di potenziale rimanga all'interno della finestra di stabilità dell'acqua.
- Se il tuo obiettivo principale è la ricerca su batterie ad alta tensione: Dai priorità a un'ampia finestra di stabilità elettrochimica e a una purezza estrema, utilizzando tipicamente sali come LiPF₆ o LiClO₄ in una miscela di solventi carbonatici organici.
- Se il tuo obiettivo principale sono gli studi sulla corrosione: Dai priorità alla creazione di un elettrolita che imiti accuratamente l'ambiente reale (ad esempio, acqua salata), assicurandoti al contempo che non corroda gli elettrodi di riferimento o di contro.
- Se il tuo obiettivo principale è la spettroelettrochimica: Dai priorità alla trasparenza ottica sia del sale che del solvente nell'intervallo di lunghezze d'onda desiderato, oltre ai requisiti elettrochimici standard.
In definitiva, l'elettrolita che scegli prepara il terreno e definisce le regole per l'intera misurazione elettrochimica.
Tabella Riassuntiva:
| Pilastro di Selezione | Considerazione Chiave | Impatto sull'Esperimento |
|---|---|---|
| Conducibilità Ionica | Elevata mobilità ionica | Minimizza la perdita di tensione (caduta IR) per un controllo accurato del potenziale. |
| Finestra di Stabilità Elettrochimica (ESW) | Intervallo di tensione di stabilità | Previene la decomposizione dell'elettrolita e l'oscuramento delle correnti di fondo. |
| Solubilità e Dissociazione | Dissociazione completa del sale in ioni | Assicura portatori di carica sufficienti per una conducibilità efficace. |
| Compatibilità Chimica | Inerzia con i componenti della cella | Evita corrosione, contaminazione e reazioni secondarie indesiderate. |
Pronto a ottimizzare i tuoi esperimenti elettrochimici con le attrezzature e i materiali di consumo giusti per il laboratorio? L'elettrolita corretto è solo una parte dell'equazione. KINTEK è specializzata nella fornitura di materiali di consumo e attrezzature di laboratorio di alta purezza, personalizzati per elettrochimica, ricerca sulle batterie, studi sulla corrosione e altro ancora. I nostri prodotti ti aiutano a ottenere il controllo preciso e i dati affidabili richiesti dal tuo lavoro.
Contatta oggi i nostri esperti per discutere le esigenze specifiche della tua applicazione e scoprire come KINTEK può supportare il successo del tuo laboratorio.
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrochimica Elettrolitica a Bagno d'Acqua a Doppio Strato
- Cella Elettrochimica per Elettrolisi Spettrale a Strato Sottile
Domande frequenti
- Quali sono le specifiche standard di apertura per una cella elettrolitica a membrana scambiabile di tipo H? Porte asimmetriche per un'elettrochimica precisa
- Come deve essere conservata la cella elettrolitica di tipo H quando non è in uso? Guida esperta per la conservazione e la manutenzione
- Qual è la struttura complessiva della cella elettrolitica a bagno d'acqua ottico a doppio strato di tipo H? Design di precisione per esperimenti controllati
- Quali caratteristiche ottiche presenta la cella elettrolitica di tipo H? Finestrini di quarzo di precisione per la fotoelettrochimica
- Quali sono i volumi tipici e le configurazioni di apertura per una cella elettrolitica a doppio strato a bagno d'acqua? Ottimizza la tua configurazione elettrochimica



















