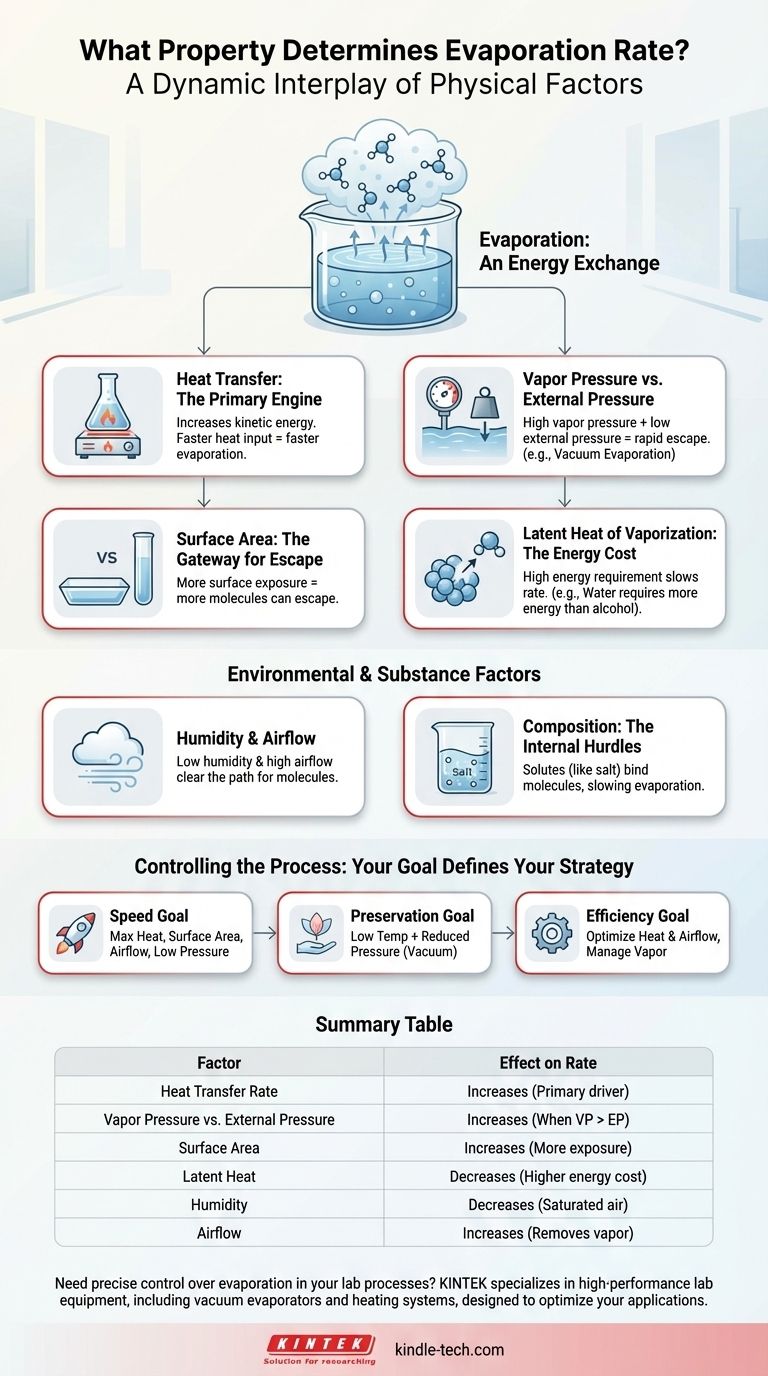
L'evaporazione non è governata da una singola proprietà, ma piuttosto da un'interazione dinamica di diversi fattori fisici chiave. Il tasso è fondamentalmente determinato dalla velocità di trasferimento del calore nel liquido, dalla pressione sopra la sua superficie e dall'energia intrinseca necessaria per trasformare il liquido in gas.
Il principio fondamentale è uno scambio di energia: l'evaporazione accelera quando l'energia viene aggiunta a un liquido più rapidamente di quanto l'ambiente circostante possa resistere alla fuga delle sue molecole. Comprendere come manipolare calore, pressione e superficie ti dà un controllo diretto su questo processo.

I Motori Principali dell'Evaporazione
Per comprendere veramente il tasso di evaporazione, dobbiamo esaminare le forze fisiche in gioco. Questi fattori lavorano in concerto per incoraggiare o ostacolare la fuga delle molecole dalla superficie di un liquido.
Trasferimento di Calore: Il Motore Primario
Il fattore più significativo è la velocità con cui l'energia termica viene fornita al liquido. Il calore aumenta l'energia cinetica delle molecole del liquido.
Quando una molecola acquisisce energia cinetica sufficiente per superare le forze intermolecolari che la legano ai suoi vicini, essa sfugge dalla superficie come gas. Pertanto, un tasso più elevato di trasferimento di calore si traduce direttamente in un tasso di evaporazione più rapido.
Pressione di Vapore e Pressione Esterna: La Battaglia in Superficie
Ogni liquido esercita una pressione di vapore, che è la forza delle sue molecole che spingono per sfuggire nella fase gassosa. Questa è contrastata dalla pressione esterna (solitamente la pressione atmosferica) che spinge verso il basso sulla superficie del liquido.
L'evaporazione avviene rapidamente quando la pressione di vapore è alta rispetto alla pressione esterna. Questo è il motivo per cui l'acqua evapora più velocemente ad alta quota dove la pressione atmosferica è più bassa.
Calore Latente di Vaporizzazione: Il Costo Energetico
Il calore latente di vaporizzazione è la quantità specifica di energia richiesta per convertire un'unità di una sostanza da liquido a gas senza cambiarne la temperatura.
Sostanze con un alto calore latente di vaporizzazione, come l'acqua, richiedono un maggiore apporto di energia per far evaporare ogni chilogrammo. Questo agisce come un freno sul tasso di evaporazione rispetto a liquidi come l'alcol, che hanno un costo energetico inferiore.
Superficie: La Porta di Fuga
L'evaporazione è un fenomeno di superficie. Solo le molecole sulla o vicino alla superficie possono sfuggire.
Aumentando la superficie—ad esempio, spargendo una pozzanghera d'acqua—si espongono più molecole all'aria, creando più opportunità per loro di sfuggire. Questo aumenta drasticamente il tasso di evaporazione complessivo.
Fattori Ambientali e Specifici della Sostanza
Oltre alla fisica di base, l'ambiente immediato e la composizione del liquido aggiungono un ulteriore livello di controllo.
Umidità e Flusso d'Aria: Liberare il Percorso
La quantità di vapore già presente nell'aria circostante, nota come umidità, influisce sul tasso netto di evaporazione. Se l'aria è già satura, c'è meno "spazio" per nuove molecole d'acqua, rallentando il processo.
Il flusso d'aria (vento) spazza via lo strato di aria umida direttamente sopra la superficie del liquido, sostituendolo con aria più secca. Questo mantiene un gradiente di concentrazione ripido e incoraggia più molecole a sfuggire.
Composizione della Sostanza: Gli Ostacoli Interni
La presenza di soluti, come sale o zucchero nell'acqua, può rallentare l'evaporazione. Queste particelle disciolte formano legami con le molecole d'acqua, richiedendo più energia per romperli.
Questo è il motivo per cui l'acqua di mare evapora più lentamente dell'acqua dolce in condizioni identiche. Le proprietà della sostanza stessa, e qualsiasi cambiamento che subisce, sono un fattore critico.
Comprendere i Compromessi
Manipolare questi fattori spesso comporta il bilanciamento di priorità contrastanti, specialmente nelle applicazioni industriali o culinarie.
Il Legame tra Pressione e Temperatura
Ridurre la pressione abbassa il punto di ebollizione di un liquido. Questa potente relazione consente una rapida evaporazione a temperature molto più basse di quanto sarebbe altrimenti richiesto.
Questa tecnica, nota come evaporazione sotto vuoto, è essenziale per concentrare sostanze sensibili al calore, come latte o succhi di frutta, senza bruciarle o degradarle.
Il Limite dell'Apporto di Calore
Sebbene aggiungere calore sia il modo più rapido per aumentare l'evaporazione, spesso esiste una temperatura massima consentita.
Superare questo limite può causare reazioni chimiche indesiderate, bruciature o decomposizione del prodotto. L'obiettivo è spesso trovare il tasso di trasferimento di calore più alto possibile che non comprometta l'integrità della sostanza.
Come Controllare l'Evaporazione per il Tuo Obiettivo
La tua strategia per gestire l'evaporazione dipende interamente dal risultato desiderato.
- Se il tuo obiettivo principale è la velocità: Massimizza il tasso di apporto di calore, aumenta la superficie, assicurati un flusso d'aria costante e, se possibile, riduci la pressione ambiente.
- Se il tuo obiettivo principale è preservare la sostanza: Usa una temperatura più bassa combinata con una pressione ridotta per ottenere l'evaporazione senza danni da calore.
- Se il tuo obiettivo principale è l'efficienza energetica: Concentrati sull'ottimizzazione del trasferimento di calore e sulla gestione del flusso d'aria per rimuovere il vapore saturo, prevenendo sprechi di energia.
In definitiva, controllare l'evaporazione è un processo di gestione del flusso di energia in entrata e in uscita da un sistema.
Tabella Riepilogativa:
| Fattore | Effetto sul Tasso di Evaporazione | Principio Chiave |
|---|---|---|
| Tasso di Trasferimento di Calore | Aumenta | Motore primario; aggiunge energia cinetica alle molecole. |
| Pressione di Vapore vs. Pressione Esterna | Aumenta quando la pressione di vapore > pressione esterna | Le molecole sfuggono più facilmente quando la pressione esterna è inferiore. |
| Superficie | Aumenta | Più molecole sono esposte in superficie, consentendo la fuga. |
| Calore Latente di Vaporizzazione | Diminuisce per sostanze con alto calore latente | Un costo energetico più elevato per molecola rallenta il tasso. |
| Umidità | Diminuisce | L'aria satura riduce il gradiente di concentrazione per la fuga. |
| Flusso d'Aria | Aumenta | Rimuove il vapore saturo, mantenendo un gradiente di concentrazione ripido. |
Hai bisogno di un controllo preciso sull'evaporazione nei tuoi processi di laboratorio? KINTEK è specializzata in attrezzature da laboratorio ad alte prestazioni, inclusi evaporatori sotto vuoto e sistemi di riscaldamento progettati per ottimizzare il trasferimento di calore, la pressione e la superficie per le tue applicazioni specifiche, sia che tu stia concentrando campioni sensibili al calore o massimizzando la produttività. Lascia che i nostri esperti ti aiutino a selezionare la soluzione giusta per migliorare l'efficienza e preservare l'integrità del campione. Contatta KINTEK oggi per discutere le tue esigenze di evaporazione in laboratorio!
Guida Visiva
Prodotti correlati
- Liofilizzatore da banco per uso di laboratorio
- Autoclave da Laboratorio Sterilizzatore a Vuoto Pulsato da Banco a Vapore
- Autoclave da Laboratorio Sterilizzatore Digitale Portatile Automatico per Pressione di Sterilizzazione
- Autoclave da Laboratorio Portatile ad Alta Pressione Sterilizzatore a Vapore per Uso di Laboratorio
- Autoclave a Vapore ad Alta Pressione da Laboratorio Verticale per Reparto di Laboratorio
Domande frequenti
- Perché gli essiccatori a congelamento da laboratorio sono considerati strumenti economici? Massimizzare il valore e minimizzare le perdite
- Come si confronta la liofilizzazione con il congelamento convenzionale per la conservazione di materiale biologico? Ottenere una conservazione a lungo termine e stabile a scaffale
- Quali industrie utilizzano comunemente le tecniche di liofilizzazione? La chiave per preservare prodotti di alto valore
- Come funziona la liofilizzazione da laboratorio per conservare i prodotti biologici? La guida definitiva alla liofilizzazione
- Qual è il processo di base della liofilizzazione? Una guida alle fasi e ai vantaggi della liofilizzazione



















