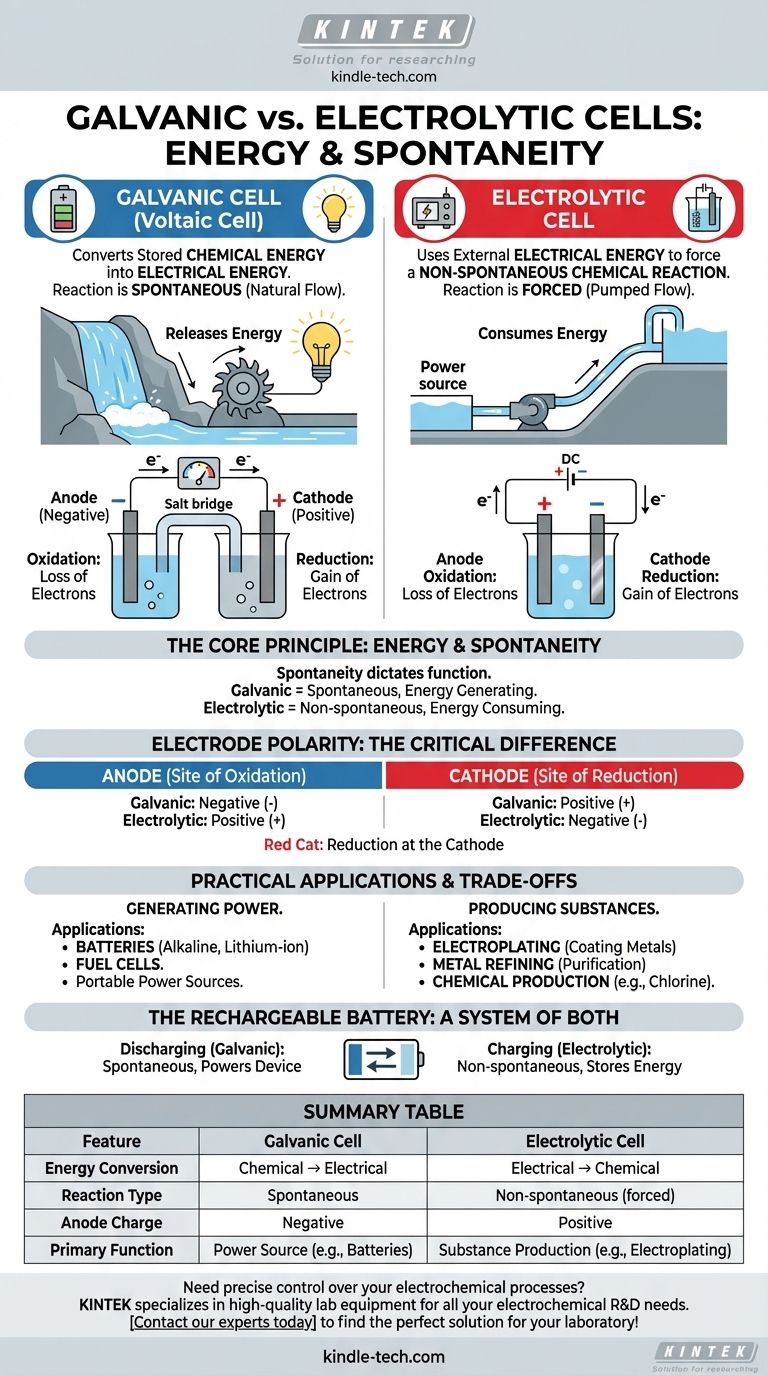
In sintesi, la differenza tra una cella galvanica e una cella elettrolitica è la direzione della conversione energetica. Una cella galvanica (o voltaica) converte l'energia chimica immagazzinata in energia elettrica attraverso una reazione spontanea, come una batteria che alimenta un dispositivo. Al contrario, una cella elettrolitica utilizza energia elettrica esterna per forzare una reazione chimica non spontanea, come nella placcatura dei metalli.
La distinzione fondamentale risiede nella spontaneità. Le celle galvaniche sfruttano una reazione chimica che avviene spontaneamente, rilasciando energia sotto forma di elettricità. Le celle elettrolitiche usano l'elettricità per forzare una reazione chimica che altrimenti non avverrebbe.

Il Principio Fondamentale: Energia e Spontaneità
Il comportamento di qualsiasi cella elettrochimica è governato dal fatto che la sua reazione redox interna sia spontanea o non spontanea. Questo singolo principio ne detta la funzione e la struttura.
Celle Galvaniche: Generazione di Energia
In una cella galvanica, la reazione chimica è spontanea. Ciò significa che i reagenti hanno un'energia potenziale più elevata rispetto ai prodotti, e la reazione procede naturalmente, rilasciando energia.
Questa energia rilasciata spinge gli elettroni attraverso un circuito esterno, creando una corrente elettrica. Pensate a una cascata: l'acqua scorre naturalmente verso il basso, e possiamo posizionare una turbina sul suo percorso per generare elettricità.
Celle Elettrolitiche: Consumo di Energia
In una cella elettrolitica, la reazione chimica desiderata è non spontanea. I prodotti si trovano in uno stato energetico più elevato rispetto ai reagenti, quindi la reazione non avverrà da sola.
Per farla avvenire, dobbiamo fornire energia da una fonte di alimentazione esterna (come una batteria o un alimentatore). Questa tensione esterna forza gli elettroni a muoversi contro la loro direzione naturale, guidando la reazione. Questo è come usare una pompa per spostare l'acqua in salita.
Come Questo Principio Definisce i Componenti della Cella
Mentre le definizioni fondamentali dell'anodo e del catodo rimangono le stesse, la loro carica (polarità) è invertita tra i due tipi di celle. Questo è un punto comune di confusione ma è una diretta conseguenza della spontaneità.
L'Anodo: Sempre il Sito di Ossidazione
In entrambi i tipi di celle, l'anodo è definito come l'elettrodo dove avviene l'ossidazione (la perdita di elettroni).
Il Catodo: Sempre il Sito di Riduzione
Allo stesso modo, in entrambi i tipi di celle, il catodo è l'elettrodo dove avviene la riduzione (l'acquisizione di elettroni). Un semplice mnemonico è "Red Cat" (Riduzione al Catodo).
La Differenza Critica: Polarità degli Elettrodi
In una cella galvanica, l'ossidazione spontanea all'anodo rilascia un flusso di elettroni. Questo accumulo di carica negativa rende l'anodo negativo e il catodo, che attrae gli elettroni, positivo.
In una cella elettrolitica, viene utilizzata una fonte di alimentazione esterna. Il suo terminale positivo è collegato all'anodo, dove forza gli elettroni a staccarsi dalla specie chimica, causando l'ossidazione. Pertanto, l'anodo è positivo e il catodo è negativo.
Applicazioni Pratiche e Compromessi
La differenza tra generare e consumare energia porta ad applicazioni nel mondo reale completamente diverse per questi due tipi di celle.
Celle Galvaniche in Pratica: Energia Portatile
Le celle galvaniche sono progettate per essere fonti di energia. La loro applicazione principale è nelle batterie, dalle batterie alcaline monouso alle celle ricaricabili agli ioni di litio nel telefono e nell'auto.
Le celle a combustibile sono un altro tipo di cella galvanica, che genera continuamente elettricità finché viene fornito combustibile (come l'idrogeno).
Celle Elettrolitiche in Pratica: Produzione e Raffinazione
Le celle elettrolitiche sono cavalli da battaglia industriali utilizzati per produrre materiali. Le applicazioni chiave includono l'elettroplaccatura (rivestimento di un oggetto con un sottile strato metallico) e la purificazione di metalli come rame e alluminio.
Sono anche essenziali per la produzione di importanti sostanze chimiche industriali, come il gas cloro e l'idrossido di sodio dall'acqua salata (salamoia).
La Batteria Ricaricabile: Un Sistema di Entrambe
Una batteria ricaricabile è l'illustrazione perfetta di entrambi i principi. Quando alimenta il vostro dispositivo, agisce come una cella galvanica, eseguendo una reazione spontanea. Quando la si collega per caricarla, una fonte di alimentazione esterna inverte il processo, trasformandola in una cella elettrolitica per guidare una reazione non spontanea e ripristinare i reagenti iniziali.
Fare la Scelta Giusta per il Vostro Obiettivo
La vostra comprensione di quale cella considerare dipende interamente dal fatto che abbiate bisogno di produrre energia o produrre una sostanza.
- Se il vostro obiettivo principale è generare energia da una reazione chimica: State lavorando con una cella galvanica, dove un processo spontaneo crea una corrente elettrica.
- Se il vostro obiettivo principale è creare una sostanza usando l'elettricità: State usando una cella elettrolitica, dove una tensione esterna guida un cambiamento chimico non spontaneo.
- Se il vostro obiettivo principale è immagazzinare e riutilizzare l'energia elettrica: Avete a che fare con un sistema ricaricabile che alterna tra essere una cella elettrolitica (carica) e una cella galvanica (scarica).
In definitiva, questi due tipi di celle sono due facce della stessa medaglia elettrochimica, definite dalla direzione del flusso di energia.
Tabella Riassuntiva:
| Caratteristica | Cella Galvanica | Cella Elettrolitica |
|---|---|---|
| Conversione Energetica | Chimica → Elettrica | Elettrica → Chimica |
| Tipo di Reazione | Spontanea | Non spontanea (forzata) |
| Carica dell'Anodo | Negativa | Positiva |
| Funzione Primaria | Fonte di Energia (es. Batterie) | Produzione di Sostanze (es. Elettroplaccatura) |
Avete bisogno di un controllo preciso sui vostri processi elettrochimici? L'attrezzatura da laboratorio giusta è fondamentale per risultati accurati, sia che stiate sviluppando nuovi materiali per batterie o raffinando tecniche di placcatura metallica. KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità per tutte le vostre esigenze di ricerca e sviluppo elettrochimico. Contattate i nostri esperti oggi stesso per trovare la soluzione perfetta per il vostro laboratorio!
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica a Diffusione di Gas Cella di Reazione a Flusso Liquido
- Bagno d'acqua per cella elettrochimica elettrolitica multifunzionale a strato singolo e doppio
Domande frequenti
- Quali sono le specifiche delle aperture sulla cella elettrolitica? Una guida alle dimensioni e alle configurazioni delle porte
- Come influisce un sistema DC a due elettrodi sulla qualità del rivestimento? Ottenere cromo trivalente denso sull'acciaio inossidabile 304L
- Quali sono le procedure post-esperimento dopo aver utilizzato la cella con una soluzione acquosa convenzionale? Garantire accuratezza e riproducibilità
- Quali sono i requisiti critici di progettazione per una cella elettrochimica a trasmissione? Ottimizza il tuo segnale XAFS
- Quali sono le precauzioni chiave da prendere quando si utilizza una cella elettrolitica Raman in situ? Garantire sicurezza e accuratezza dei dati
- Cosa è importante riguardo al controllo della temperatura per la cella elettrolitica di tipo H? Garantire precisione e integrità dei dati
- Perché i reattori a celle a combustibile vengono utilizzati nei sistemi elettrochimici per la produzione di perossido di idrogeno? Massimizzare l'efficienza
- Quali sono le configurazioni standard di apertura per le celle elettrolitiche interamente in PTFE non sigillate e sigillate?







