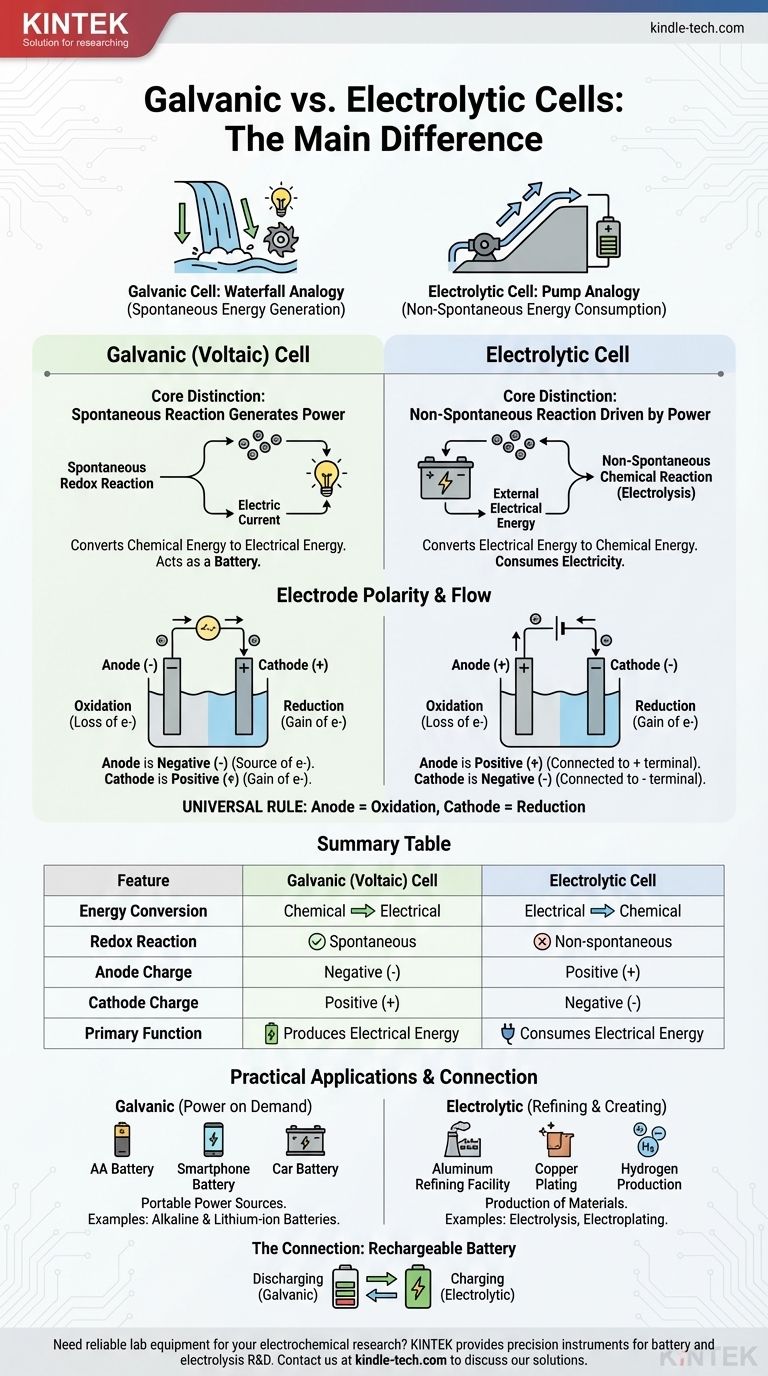
La differenza fondamentale risiede nella direzione della conversione energetica e nella natura della reazione chimica. Una cella galvanica converte spontaneamente l'energia chimica immagazzinata in energia elettrica, fungendo di fatto da batteria. Al contrario, una cella elettrolitica utilizza una fonte esterna di energia elettrica per forzare una reazione chimica non spontanea.
Pensala come la differenza tra una cascata che genera energia e una pompa che usa energia. Una cella galvanica è come una cascata, dove un processo naturale e spontaneo (l'acqua che scorre a valle) crea energia. Una cella elettrolitica è come una pompa, che usa energia esterna per forzare un processo che non avverrebbe da solo (spingere l'acqua in salita).

La distinzione fondamentale: spontaneità e flusso di energia
Il comportamento di queste due celle è governato da un principio: se la reazione redox interna avviene da sola.
Celle Galvaniche: Reazioni Spontanee che Generano Energia
In una cella galvanica, conosciuta anche come cella voltaica, i reagenti chimici scelti hanno una tendenza naturale a reagire tra loro.
Questa reazione redox spontanea rilascia energia. La cella è costruita per incanalare questa energia non come calore, ma come un flusso diretto di elettroni—una corrente elettrica.
In sostanza, una cella galvanica sfrutta un processo chimico naturale per compiere lavoro elettrico. Questo è il principio alla base di tutte le batterie.
Celle Elettrolitiche: Reazioni Non Spontanee Azionate dall'Energia
In una cella elettrolitica, la reazione chimica è non spontanea. I reagenti non interagiranno da soli per produrre i prodotti desiderati.
Per far avvenire la reazione, una fonte di alimentazione esterna (come una batteria o un alimentatore) è collegata alla cella. Questa tensione esterna fornisce l'energia necessaria per forzare il movimento degli elettroni e guidare il cambiamento chimico.
Le celle elettrolitiche consumano elettricità per creare un prodotto chimico, un processo noto come elettrolisi.
Uno sguardo più approfondito alla polarità degli elettrodi
Mentre i termini "anodo" e "catodo" sono costanti, la loro carica (polarità) è un punto di confusione comune perché è invertita tra i due tipi di celle. La chiave è ricordare cosa guida il flusso di elettroni.
L'Anodo: Sempre il Sito dell'Ossidazione
In entrambi i tipi di celle, l'anodo è definito come l'elettrodo dove avviene l'ossidazione (la perdita di elettroni). Questa definizione è universale.
Il Catodo: Sempre il Sito della Riduzione
Allo stesso modo, il catodo è sempre l'elettrodo dove avviene la riduzione (l'acquisizione di elettroni). Questa è la seconda regola universale.
Il Cambiamento Critico: Perché la Polarità Cambia
La differenza di polarità deriva dal fatto che la reazione sia spontanea o forzata.
In una cella galvanica, l'ossidazione spontanea all'anodo rilascia elettroni, creando una carica negativa. L'anodo è il terminale negativo perché è la fonte di elettroni che si spingono nel circuito.
In una cella elettrolitica, viene utilizzata una fonte di alimentazione esterna. Il suo terminale positivo attira gli elettroni dall'anodo per forzare l'ossidazione. Pertanto, l'anodo è collegato al lato positivo e diventa il terminale positivo.
| Caratteristica | Cella Galvanica (Voltaica) | Cella Elettrolitica |
|---|---|---|
| Conversione Energetica | Da Chimica a Elettrica | Da Elettrica a Chimica |
| Reazione Redox | Spontanea | Non Spontanea |
| Carica dell'Anodo | Negativa (-) | Positiva (+) |
| Carica del Catodo | Positiva (+) | Negativa (-) |
| Funzione Primaria | Produce Energia Elettrica | Consuma Energia Elettrica |
Comprendere le applicazioni pratiche
Questa differenza fondamentale porta a usi distinti nella tecnologia e nell'industria.
Celle Galvaniche in Azione: Energia su Richiesta
Le celle galvaniche sono progettate per essere fonti portatili di energia elettrica. Esempi comuni includono tutti i tipi di batterie, dalle normali batterie alcaline AA alla batteria agli ioni di litio del tuo telefono.
Celle Elettrolitiche al Lavoro: Raffinazione e Creazione
Le celle elettrolitiche usano energia per produrre materiali. Processi industriali chiave si basano sull'elettrolisi, come la produzione di alluminio puro dal suo minerale, la raffinazione del rame e la scissione dell'acqua per produrre idrogeno e ossigeno gassoso. L'elettrodeposizione, dove un sottile strato di metallo come argento o cromo viene depositato su un altro oggetto, è un'altra applicazione comune.
La Connessione: Come Funziona una Batteria Ricaricabile
Una batteria ricaricabile è l'illustrazione perfetta di entrambi i tipi di celle in un unico dispositivo.
Quando alimenta il tuo dispositivo (scarica), funziona come una cella galvanica. Una reazione chimica spontanea all'interno della batteria produce una corrente elettrica.
Quando la colleghi per caricarla, il caricabatterie agisce come una fonte di alimentazione esterna. Applica una tensione che forza la reazione inversa, non spontanea, a verificarsi, ripristinando i reagenti. Durante la carica, la batteria funziona come una cella elettrolitica.
Fare la Scelta Giusta per il Tuo Obiettivo
Il tuo obiettivo determina quale quadro elettrochimico stai utilizzando.
- Se il tuo obiettivo principale è generare elettricità da un processo chimico: Stai descrivendo una cella galvanica (voltaica).
- Se il tuo obiettivo principale è utilizzare l'elettricità per guidare un cambiamento chimico specifico: Stai lavorando con una cella elettrolitica.
- Se stai analizzando una batteria ricaricabile: Ricorda che funziona come una cella galvanica durante la scarica e una cella elettrolitica durante la ricarica.
In definitiva, la spontaneità della reazione e la conseguente direzione del flusso di energia sono le caratteristiche distintive che separano questi due pilastri dell'elettrochimica.
Tabella riassuntiva:
| Caratteristica | Cella Galvanica (Voltaica) | Cella Elettrolitica |
|---|---|---|
| Conversione Energetica | Da Chimica a Elettrica | Da Elettrica a Chimica |
| Reazione Redox | Spontanea | Non Spontanea |
| Carica dell'Anodo | Negativa (-) | Positiva (+) |
| Carica del Catodo | Positiva (+) | Negativa (-) |
| Funzione Primaria | Produce Energia Elettrica | Consuma Energia Elettrica |
Hai bisogno di attrezzature da laboratorio affidabili per la tua ricerca elettrochimica? Che tu stia sviluppando nuove tecnologie per batterie o ottimizzando processi di elettrolisi, KINTEK fornisce gli strumenti di precisione e i materiali di consumo di cui il tuo laboratorio ha bisogno. Contattaci oggi per discutere come le nostre soluzioni possono alimentare le tue innovazioni!
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica a Diffusione di Gas Cella di Reazione a Flusso Liquido
- Bagno d'acqua per cella elettrochimica elettrolitica multifunzionale a strato singolo e doppio
Domande frequenti
- Qual è la procedura per pulire la cella dopo un esperimento? Garantisci la precisione del laboratorio con questa guida in 3 passaggi
- Qual è il sistema sperimentale tipico utilizzato con una cella elettrolitica a doppio bagno d'acqua? Ottenere un controllo elettrochimico preciso
- Quali tipi di elettrodi vengono utilizzati nel sistema di celle elettrolitiche interamente in PTFE? Ottimizza la tua analisi elettrochimica
- Quali sono i tre componenti essenziali che costituiscono una cella elettrolitica? Elementi chiave della sintesi chimica
- Come si può controllare la reazione all'interno di una cella elettrolitica? Padroneggiare Tensione, Corrente ed Elettrolita
- Quali sono le linee guida per la manutenzione e la cura regolari della cella elettrolitica e degli elettrodi? Garantire longevità e risultati accurati
- Quali sono le applicazioni primarie della cella elettrolitica interamente in quarzo? Essenziale per analisi ad alta purezza e ottiche
- Come si collega una cella elettrolitica di tipo H a una fonte di alimentazione? Una guida passo passo per esperimenti sicuri e accurati















