In termini tecnici, una cella elettrolitica è un tipo specifico di cella elettrochimica. Sebbene rientri in questa ampia categoria, è fondamentale capire che "cella elettrochimica" descrive anche un altro dispositivo—la cella galvanica—che svolge la funzione esattamente opposta.
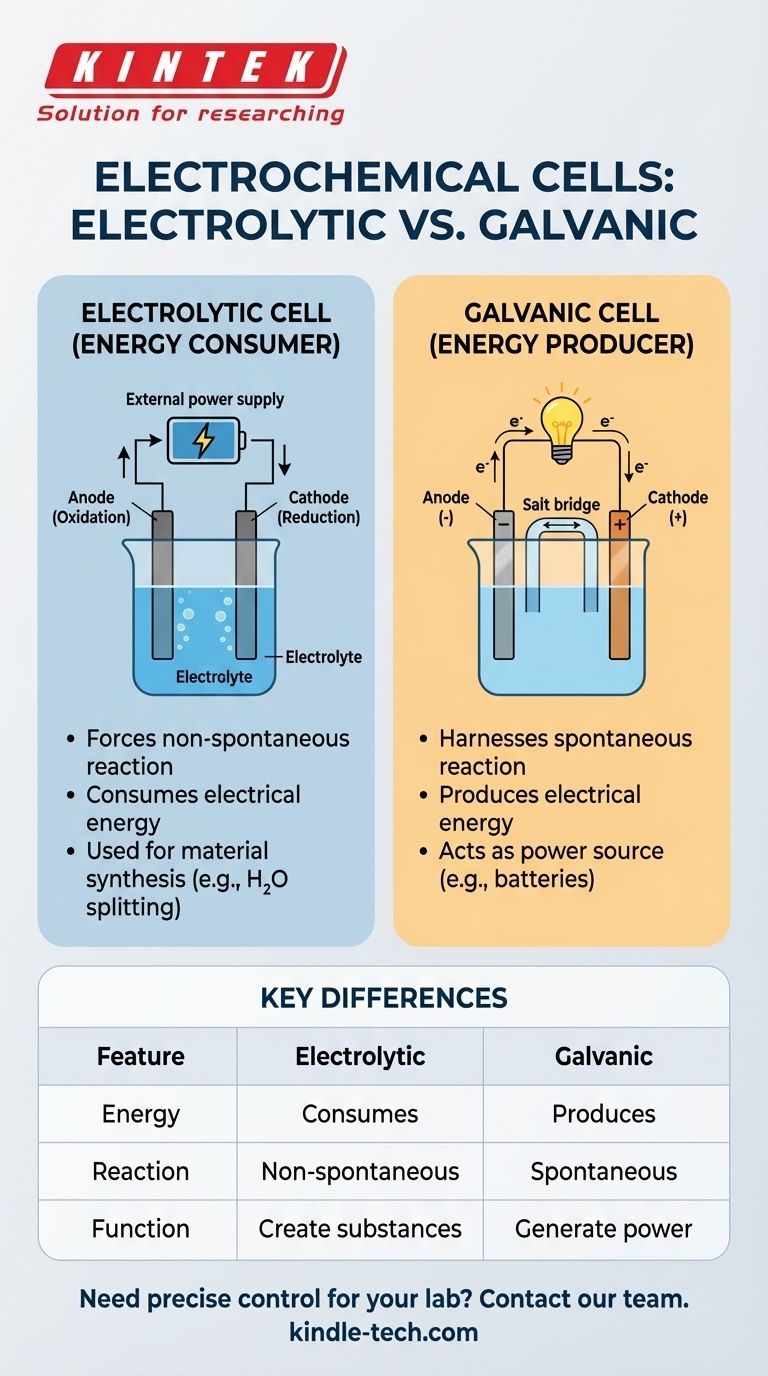
La distinzione cruciale è questa: una cella elettrolitica utilizza energia elettrica esterna per forzare una reazione chimica che non avverrebbe spontaneamente. Consuma energia. Al contrario, una cella galvanica (come una batteria) utilizza una reazione chimica spontanea per produrre energia elettrica.

La Funzione Principale: Forzare una Reazione Chimica
Cos'è l'Elettrolisi?
L'elettrolisi è il processo che utilizza una corrente elettrica continua (DC) per innescare una reazione chimica non spontanea. In termini semplici, si tratta di usare l'elettricità per far avvenire un cambiamento chimico.
Il dispositivo in cui avviene questo processo è la cella elettrolitica.
Il Ruolo dell'Alimentazione Esterna
La caratteristica distintiva di una cella elettrolitica è la sua necessità di una fonte di alimentazione esterna, come una batteria o un alimentatore. Questa tensione esterna supera la barriera energetica naturale della reazione, costringendo le sostanze chimiche a reagire.
Componenti Chiave
Una cella elettrolitica è composta da due elettrodi, un anodo e un catodo, immersi in una soluzione liquida chiamata elettrolita. La fonte di alimentazione esterna estrae elettroni dall'anodo (ossidazione) e li spinge al catodo (riduzione), innescando il cambiamento chimico desiderato.
Elettrolitica vs. Galvanica: L'ombrello della "Cella Elettrochimica"
Il termine cella elettrochimica è una categoria genitore per qualsiasi dispositivo che converte energia chimica in energia elettrica e viceversa. Comprendere i due tipi principali è essenziale per chiarezza.
Celle Elettrolitiche: Consumatori di Energia
Queste celle consumano energia elettrica per produrre un cambiamento chimico. Il loro scopo principale è creare sostanze o alterare materiali attraverso una reazione forzata.
Un esempio comune è l'uso di una cella elettrolitica per scindere l'acqua (H₂O) in idrogeno e ossigeno gassoso, un processo che richiede un significativo apporto energetico.
Celle Galvaniche (Voltaiche): Produttori di Energia
Queste celle fanno l'opposto. Sfruttano una reazione chimica spontanea per generare una corrente elettrica. Questo è il principio fondamentale alla base di tutte le batterie comuni.
Quando si usa una batteria, si sta usando una cella galvanica per convertire l'energia chimica immagazzinata in energia elettrica utilizzabile.
Perché la Distinzione è Importante
Chiamare una cella elettrolitica "cella elettrochimica" è tecnicamente corretto ma impreciso. È come chiamare un quadrato un "rettangolo". Sebbene vero, omette le proprietà specifiche che lo definiscono. La differenza chiave è sempre la direzione della conversione energetica.
Applicazioni Comuni e Compromessi
Dove viene Utilizzata l'Elettrolisi
La capacità di forzare reazioni chimiche ha un immenso valore industriale. Le celle elettrolitiche sono essenziali per produrre idrogeno puro per il carburante, raffinare metalli come alluminio e rame dai minerali e galvanizzare oggetti con un sottile strato di metallo come cromo o oro.
Il Compromesso Principale: Costo Energetico
La principale limitazione dell'elettrolisi è il suo elevato consumo energetico. Poiché si sta forzando una reazione non spontanea, il processo richiede sempre più energia rispetto all'energia chimica che si immagazzina o al valore del prodotto creato. Questo costo energetico è la considerazione economica e ambientale centrale per qualsiasi processo di elettrolisi industriale.
Come Identificare la Cella Giusta per il Tuo Obiettivo
- Se il tuo obiettivo principale è immagazzinare energia o creare materiali (come carburante a idrogeno o alluminio puro): Hai a che fare con una cella elettrolitica, che consuma elettricità per innescare una reazione chimica.
- Se il tuo obiettivo principale è generare energia da una fonte chimica (come una batteria): Hai a che fare con una cella galvanica (o voltaica), che produce elettricità da una reazione spontanea.
- Se il tuo obiettivo principale è il campo scientifico generale che copre entrambi i processi: Dovresti usare il termine generico cella elettrochimica.
In definitiva, comprendere la direzione del flusso di energia—se viene consumata o prodotta—è la chiave per distinguere tra questi dispositivi fondamentali.
Tabella Riassuntiva:
| Caratteristica | Cella Elettrolitica | Cella Galvanica |
|---|---|---|
| Conversione Energetica | Consuma energia elettrica | Produce energia elettrica |
| Tipo di Reazione | Non spontanea (forzata) | Spontanea |
| Funzione Primaria | Creare sostanze (es. H₂, metalli raffinati) | Generare energia (es. batterie) |
| Fonte di Alimentazione | Richiede una fonte esterna (es. batteria, alimentatore) | È la fonte di alimentazione stessa |
Hai bisogno di un controllo preciso sulle reazioni chimiche nel tuo laboratorio?
Che la tua ricerca riguardi la sintesi di materiali, la galvanoplastica o l'accumulo di energia, disporre dell'attrezzatura giusta è fondamentale. KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità, comprese celle elettrochimiche e alimentatori, progettati per affidabilità e precisione.
Lascia che i nostri esperti ti aiutino a selezionare la configurazione perfetta per la tua applicazione specifica. Contatta il nostro team oggi stesso per discutere le tue esigenze di laboratorio e scoprire come KINTEK può supportare i tuoi obiettivi di ricerca.
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Bagno d'acqua a doppio strato a cinque porte Cella elettrolitica elettrochimica
- Cella Elettrochimica Elettrolitica a Bagno d'Acqua a Doppio Strato
- Celle Elettrolitiche PEM Personalizzabili per Diverse Applicazioni di Ricerca
- Cella Elettrolitica Tipo H Tripla Elettrochimica
Domande frequenti
- Quali precauzioni di sicurezza sono necessarie durante un esperimento di elettrolisi? Una guida alla gestione dei pericoli chimici, elettrici e fisici
- Di che materiale è fatto il corpo della cella elettrolitica? Vetro borosilicato alto per un'elettrochimica affidabile
- Quali sono le funzioni principali della cella elettrolitica nell'esfoliazione della grafite? Produzione di Grafene Ingegnerizzato
- Quali sono le proprietà dei materiali del corpo della cella elettrolitica in acrilico? | Trasparenza, Sicurezza e Resistenza Chimica
- Quali controlli devono essere eseguiti prima di utilizzare la cella elettrolitica? Garantire sicurezza e accuratezza nel tuo laboratorio
- Qual è il ruolo di una cella elettrolitica in vetro borosilicato con tubi laterali nella CGDE? Ottimizzare la sicurezza e l'accuratezza dei dati
- Qual è il volume tipico della cella elettrolitica Raman in situ? Esplora le opzioni standard da 20 ml e personalizzate
- Come gestire i guasti della cella elettrolitica? Una guida alla diagnosi e riparazione sicura



















