Scoperte storiche in elettrochimica
L'esperimento della rana di Galvani
Nel 1791, lo scienziato italiano Luigi Galvani condusse un esperimento rivoluzionario che avrebbe collegato per sempre biologia ed elettrochimica. Durante la dissezione di una zampa di rana, Galvani notò che la zampa si contraeva quando entrava in contatto con due metalli diversi. Questa osservazione, apparentemente semplice, portò a una profonda consapevolezza: i tessuti biologici potevano generare e rispondere a segnali elettrici.
Questa scoperta non era solo una curiosità accademica, ma aveva anche implicazioni pratiche. Il fenomeno osservato da Galvani fu in seguito chiamato "azione galvanica" e pose le basi per lo sviluppo di dispositivi come il galvanometro, uno strumento utilizzato per misurare piccole correnti elettriche. Inoltre, il processo di galvanizzazione - il rivestimento dei metalli per prevenire la corrosione - è stato chiamato così in suo onore, sottolineando l'impatto duraturo del suo lavoro.
L'esperimento di Galvani ha rappresentato un momento cruciale nella storia della scienza, colmando il divario tra scienze della vita e scienze fisiche. Dimostrò che i sistemi biologici potevano essere compresi attraverso la lente dei principi elettrochimici, aprendo la strada ai futuri progressi in entrambi i campi.
L'invenzione di Volta della pila voltaica
Nel 1799, Alessandro Volta, un fisico italiano, fece una scoperta rivoluzionaria che gettò le basi dei moderni sistemi elettrochimici. Inventò la prima fonte di energia chimica, nota come pila di Volta, che consisteva essenzialmente in una pila di dischi di rame e zinco separati da un panno o da un cartone inumidito e imbevuto di salamoia. Questo semplice ma ingegnoso dispositivo era in grado di generare una corrente elettrica costante, segnando l'alba della generazione pratica di elettricità.
L'importanza dell'invenzione di Volta fu presto compresa e stimolò ulteriori ricerche sulle potenziali applicazioni di questa nuova fonte di energia. Solo un anno dopo, nel 1800, William Nicholson e Anthony Carlisle utilizzarono una pila di Volta per condurre la prima elettrolisi dell'acqua. Durante l'esperimento osservarono la precipitazione di gas, in particolare idrogeno e ossigeno, che confermavano la decomposizione delle molecole d'acqua nei loro elementi costitutivi sotto l'influenza di una corrente elettrica.
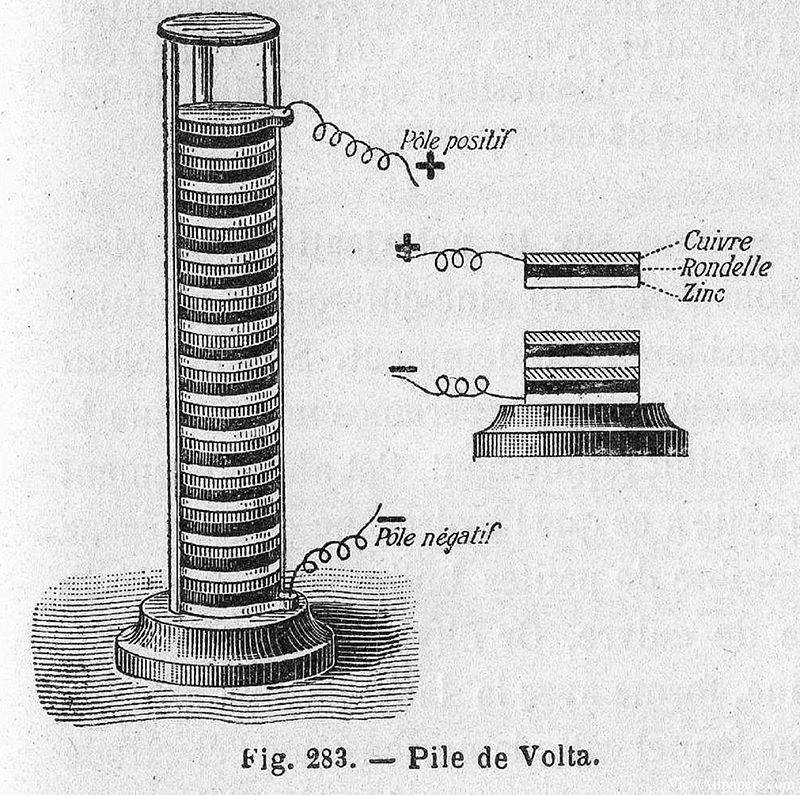
Questa scoperta non solo convalidò il concetto di elettrolisi, ma dimostrò anche l'utilità pratica della pila di Volta nella sperimentazione scientifica. La capacità di scomporre i composti nelle loro parti elementari utilizzando l'elettricità aprì nuove strade per la ricerca in chimica e fisica, aprendo la strada a futuri progressi nella teoria e nelle applicazioni elettrochimiche.
Successi dell'elettrolisi
Nel 1803, Humphry Davy ottenne un successo rivoluzionario nel campo dell'elettrochimica, isolando con successo i metalli potassio e sodio attraverso il processo di elettrolisi. Questa scoperta monumentale non solo dimostrò la potenza dei metodi elettrochimici, ma aprì anche la strada alla produzione di monomeri metallici attivi, essenziali in diverse applicazioni industriali.
Gli esperimenti di Davy prevedevano l'uso di una pila di Volta, la prima fonte di energia chimica inventata da Alessandro Volta. Facendo passare una corrente elettrica attraverso i sali fusi, Davy fu in grado di decomporre questi composti e di ottenere metalli puri. Questa tecnica segnò un significativo progresso nell'estrazione dei metalli reattivi, che in precedenza erano difficili da isolare con i metodi chimici tradizionali.
Le implicazioni del lavoro di Davy andarono oltre il laboratorio. Il suo successo nell'elettrolisi gettò le basi per le future ricerche sui processi elettrochimici, portando allo sviluppo di metodi più efficienti per l'estrazione e la purificazione dei metalli. Questa scoperta ha anche sottolineato il potenziale delle tecniche elettrochimiche in vari settori industriali, dalla metallurgia alla produzione chimica.
Inoltre, le scoperte di Davy contribuirono a una più ampia comprensione dei principi elettrochimici, ponendo le basi per i successivi progressi teorici, come la legge di Faraday sull'elettrolisi e l'equazione di Nernst. Questi quadri teorici, a loro volta, hanno consentito studi quantitativi più precisi dei fenomeni elettrochimici, facendo progredire ulteriormente il campo.
In sintesi, il successo dell'elettrolisi del potassio e del sodio realizzata da Davy nel 1803 ha rappresentato un momento cruciale nella storia dell'elettrochimica, dimostrando le applicazioni pratiche dei metodi elettrochimici e ponendo le basi per le future innovazioni del settore.
Fondamenti teorici dell'elettrochimica
La legge di Faraday sull'elettrolisi
Nel 1834 Michael Faraday, fisico e chimico all'avanguardia, formulò la legge dell'elettrolisi, una pietra miliare nel campo dell'elettrochimica. Questa legge ha fornito un quadro quantitativo per la comprensione e l'analisi dei fenomeni elettrochimici, facendo progredire in modo significativo le basi teoriche della disciplina. Il lavoro di Faraday è stato fondamentale per colmare il divario tra osservazioni empiriche e modelli teorici, gettando le basi per le future scoperte e applicazioni dell'elettrochimica.
La legge di Faraday sull'elettrolisi è composta da due principi fondamentali:
- Prima legge: La massa di una sostanza depositata o liberata su un elettrodo durante l'elettrolisi è direttamente proporzionale alla quantità di elettricità passata attraverso l'elettrolita.
- Seconda legge: La massa di una sostanza depositata o liberata a un elettrodo durante l'elettrolisi è direttamente proporzionale al peso chimico equivalente della sostanza.
Queste leggi hanno permesso agli scienziati di misurare con precisione la quantità di materiale trasformato durante una reazione elettrochimica, facilitando lo sviluppo di procedure e tecniche standardizzate in elettrochimica. Quantificando la relazione tra la corrente elettrica, il tempo e i cambiamenti chimici risultanti, le leggi di Faraday hanno fornito un metodo solido per studiare e prevedere i processi elettrochimici.
L'impatto del lavoro di Faraday andò oltre la semplice quantificazione. Le sue leggi hanno favorito una comprensione più approfondita dei meccanismi alla base dell'elettrolisi, che a sua volta ha portato a progressi in diverse applicazioni pratiche. Queste applicazioni spaziano dai processi industriali come la raffinazione dei metalli e la galvanoplastica allo sviluppo di batterie e celle a combustibile, che sono parte integrante dei moderni sistemi energetici.
Inoltre, i contributi di Faraday hanno posto le basi per i successivi sviluppi teorici dell'elettrochimica. Le sue leggi sono state fondamentali per il lavoro di scienziati successivi come Walther Nernst, che ha derivato l'equazione di Nernst, e Julius Tafel, che ha formulato l'equazione di Tafel. Questi progressi hanno ulteriormente perfezionato la comprensione dei potenziali elettrodici, della cinetica di reazione e del comportamento degli ioni in soluzione, tutti aspetti critici della moderna ricerca elettrochimica.
In sintesi, la legge di Faraday sull'elettrolisi non solo rivoluzionò lo studio quantitativo dei fenomeni elettrochimici, ma pose anche solide basi teoriche per il nascente campo dell'elettrochimica. Il suo lavoro continua a influenzare e ispirare la ricerca e le applicazioni contemporanee, sottolineando il significato duraturo del suo contributo alla scienza.
L'equazione di Nernst
Nel 1889, il chimico tedesco Walther Nernst diede un contributo rivoluzionario al campo dell'elettrochimica, ricavando una relazione matematica che collegava il potenziale dell'elettrodo alla concentrazione delle sostanze coinvolte nella reazione elettrochimica. Questa relazione, oggi nota come equazione di Nernst, è diventata una pietra miliare nello studio dei sistemi elettrochimici.
L'equazione di Nernst fornisce un mezzo quantitativo per prevedere il potenziale di una cella elettrochimica in condizioni non standard, il che è fondamentale per comprendere e controllare i processi elettrochimici. È espressa come:
[ E = E^\circ - \frac{RT}{nF} \ln Q ]
dove:
- ( E ) è il potenziale dell'elettrodo.
- ( E^\circ ) è il potenziale elettrodico standard.
- ( R ) è la costante universale dei gas.
- ( T ) è la temperatura in Kelvin.
- ( n ) è il numero di moli di elettroni trasferiti nella reazione.
- ( F ) è la costante di Faraday.
- ( Q ) è il quoziente di reazione.
L'equazione dimostra come le variazioni di concentrazione possano influenzare il potenziale di un elettrodo, fondamentale per applicazioni che vanno dalla progettazione di batterie ai processi di elettrolisi industriale. Consentendo agli scienziati di prevedere e manipolare i potenziali degli elettrodi, l'equazione di Nernst ha fatto progredire notevolmente la nostra capacità di progettare e ottimizzare i sistemi elettrochimici.
Questa scoperta non è stata solo un trionfo teorico, ma anche pratico, in quanto ha fornito uno strumento a scienziati e ingegneri per comprendere e controllare meglio il comportamento delle cellule elettrochimiche in varie condizioni. L'equazione di Nernst rimane una parte indispensabile della teoria e della pratica elettrochimica, evidenziando il profondo impatto del lavoro di Nernst sul campo.
L'equazione di Tafel
Nel 1905, Julius Tafel introdusse una formula empirica innovativa che stabiliva una relazione diretta tra la densità di corrente e il potenziale di idrogeno. Questa equazione, nota come equazione di Tafel, ha avuto un ruolo fondamentale nel far progredire la nostra comprensione della cinetica elettrochimica. Il lavoro di Tafel è stato fondamentale per chiarire i meccanismi alla base della velocità delle reazioni elettrochimiche, in particolare quelle che coinvolgono l'evoluzione dell'idrogeno.
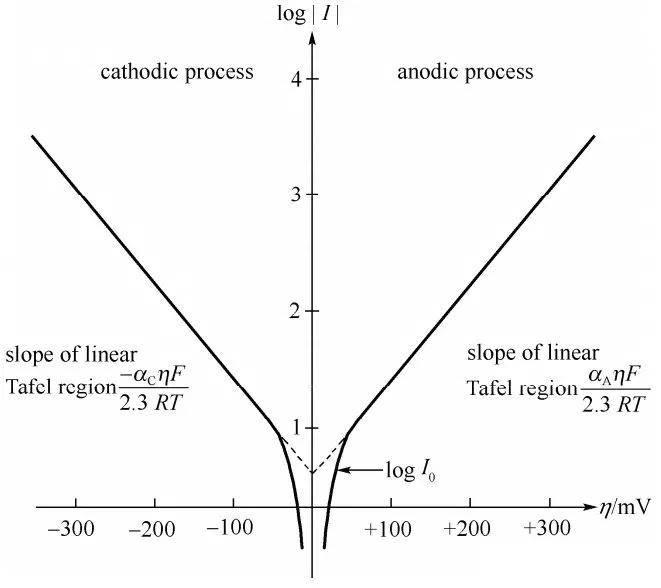
L'equazione di Tafel è tipicamente espressa come:
$$ \eta = a + b \log(i) $$
dove:
- (\eta) è il potenziale di eccesso,
- (i) è la densità di corrente,
- (a) e (b) sono costanti specifiche del materiale dell'elettrodo e delle condizioni di reazione.
L'importanza dell'equazione di Tafel risiede nella sua capacità di descrivere quantitativamente la velocità dei processi elettrochimici, che è fondamentale per ottimizzare i materiali degli elettrodi e le condizioni di reazione. Questa legge empirica è stata ampiamente convalidata e applicata in diversi sistemi elettrochimici, dalla ricerca di base alle applicazioni industriali.
| Parametro | Descrizione |
|---|---|
| (\eta) | Sovrapotenziale, la tensione supplementare richiesta oltre il potenziale di equilibrio. |
| (i) | Densità di corrente, la corrente per unità di area della superficie dell'elettrodo |
| (a) | Costante legata alla densità di corrente di scambio e al fattore di simmetria |
| (b) | Pendenza di Tafel, correlata al coefficiente di trasferimento di carica |
Il lavoro pionieristico di Tafel ha gettato le basi per le successive ricerche sulla cinetica elettrochimica, influenzando lo sviluppo di teorie e tecniche più sofisticate. La sua equazione rimane una pietra miliare nel campo, evidenziando l'intricata interazione tra processi elettrici e chimici nell'elettrochimica.
Cinetica e tecniche elettrochimiche
Dal 1940 in poi, il campo dell'elettrochimica interfacciale ha registrato progressi significativi, in particolare nella comprensione della struttura del doppio strato e della cinetica della precipitazione dell'idrogeno. Questi sviluppi hanno posto le basi per teorie e tecniche più sofisticate nella cinetica elettrochimica. Uno dei contributi più significativi di questo periodo fu la definizione della teoria microscopica di Marcus sul trasferimento di elettroni. Questa teoria ha fornito un quadro dettagliato per capire come gli elettroni si muovono attraverso le interfacce, un aspetto cruciale per molti processi elettrochimici.
I progressi nella cinetica elettrochimica non si sono limitati ai costrutti teorici. Anche le tecniche sperimentali si sono evolute, consentendo ai ricercatori di sondare il comportamento di elettroni e ioni alle interfacce con maggiore precisione. Ad esempio, lo sviluppo di nuovi metodi spettroscopici ha permesso di osservare in tempo reale le reazioni chimiche che avvengono sulle superfici degli elettrodi. Queste tecniche sono state fondamentali per convalidare e perfezionare i modelli teorici, come la teoria di Marcus, fornendo dati empirici che possono essere confrontati direttamente con le previsioni teoriche.
Inoltre, l'interazione tra progressi teorici e sperimentali ha portato allo sviluppo di sistemi elettrochimici più efficienti. Ad esempio, la comprensione della cinetica di precipitazione dell'idrogeno è stata applicata alla progettazione di celle a combustibile e batterie migliori, essenziali per le moderne tecnologie di accumulo e conversione dell'energia. Questi sistemi beneficiano di una cinetica migliorata, che porta a una maggiore efficienza e a una maggiore durata operativa.
In sintesi, il periodo che va dal 1940 in poi ha segnato un'epoca di trasformazione della cinetica e delle tecniche elettrochimiche. La sinergia tra intuizioni teoriche e capacità sperimentali non solo ha approfondito la comprensione dei processi fondamentali, ma ha anche aperto la strada ad applicazioni pratiche nel campo dell'energia e della scienza dei materiali.
Tecniche elettrochimiche in situ
Sin dalla loro nascita negli anni '70, le tecniche elettrochimiche in situ hanno rivoluzionato l'esplorazione dei meccanismi elettrochimici. Queste tecniche consentono ai ricercatori di osservare e analizzare i processi elettrochimici direttamente all'interno dei loro ambienti operativi, fornendo una visione senza precedenti della dinamica delle reazioni all'interfaccia elettrodo-elettrolita.
Uno dei progressi più significativi in questo campo è l'integrazione della spettroscopia elettrochimica in situ di assorbimento dei raggi X (XAS). Questo metodo consente di monitorare in tempo reale i cambiamenti della struttura elettronica e degli stati di ossidazione dei materiali durante le reazioni elettrochimiche. Combinando la XAS con le tecniche elettrochimiche, gli scienziati possono correlare le trasformazioni strutturali con le prestazioni elettrochimiche, approfondendo così la comprensione dei processi catalitici e dei materiali elettrodici.
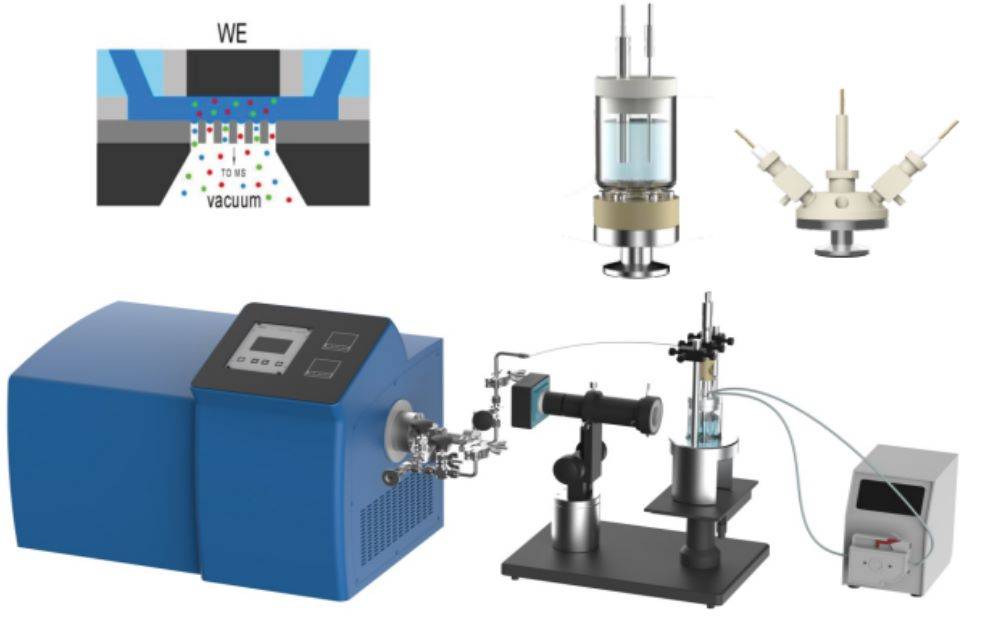
Oltre alla XAS, si sono affermate anche altre tecniche in situ come la microscopia elettrochimica a scansione (SECM) e la spettroscopia Raman in situ. La SECM consente la risoluzione spaziale dei processi elettrochimici su scala micrometrica, mentre la spettroscopia Raman in situ fornisce informazioni vibrazionali dettagliate sulle specie coinvolte nelle reazioni.
La versatilità e la precisione delle tecniche elettrochimiche in situ non solo hanno potenziato la ricerca fondamentale, ma hanno anche accelerato lo sviluppo di applicazioni pratiche. Ad esempio, queste tecniche sono fondamentali per ottimizzare le prestazioni di batterie, celle a combustibile ed elettrocatalizzatori. Fornendo dati in tempo reale sugli intermedi di reazione e sulle modifiche della superficie, i metodi in situ aiutano a progettare dispositivi elettrochimici più efficienti e duraturi.
Inoltre, la continua evoluzione di queste tecniche ne sta ampliando l'applicabilità. I progressi nella strumentazione e nei metodi di analisi dei dati consentono una maggiore risoluzione, un'acquisizione più rapida dei dati e un'interpretazione più accurata dei risultati. Questi progressi stanno aprendo la strada alla prossima generazione di ricerca elettrochimica, in cui le tecniche in situ svolgeranno un ruolo fondamentale per svelare le complessità dei sistemi elettrochimici.
Direzioni moderne dell'elettrochimica
Meccanismi elettrochimici microscopici
L'esplorazione dei processi elettrochimici su scala atomica e molecolare è un punto focale della ricerca contemporanea. Questo campo impiega principalmente in situ e non in situ per analizzare gli intricati meccanismi che regolano questi processi. Queste tecniche consentono ai ricercatori di osservare e analizzare le reazioni elettrochimiche mentre avvengono, fornendo approfondimenti senza precedenti sulle dinamiche in gioco.
Uno dei principali progressi in questo settore è l'uso di spettroscopia elettrochimica in situ di assorbimento dei raggi X (XAS) . Questo metodo consente di monitorare in tempo reale i cambiamenti della struttura elettronica e degli stati di ossidazione dei materiali durante le reazioni elettrochimiche. Ad esempio, la XAS può rivelare come cambia la superficie di un catalizzatore durante la catalisi di una reazione specifica, offrendo indizi per ottimizzare il catalizzatore per ottenere prestazioni migliori.
Inoltre, microscopia a scansione a tunnel (STM) e microscopia a forza atomica (AFM) sono state fondamentali per visualizzare la morfologia superficiale e le proprietà elettroniche degli elettrodi a livello atomico. Queste tecniche sono state fondamentali per capire come i difetti superficiali, gli adsorbati e altre caratteristiche microscopiche influenzino il comportamento elettrochimico dei materiali.
Per costruire un meccanismo di reazione completo e razionale, i ricercatori spesso combinano queste osservazioni microscopiche con modelli teorici. Per esempio, teoria funzionale della densità (DFT) funzionale della densità (DFT) è in grado di prevedere i paesaggi energetici dei potenziali percorsi di reazione, mentre la dinamica molecolare (MD) possono modellare il comportamento in funzione del tempo di ioni e molecole nell'elettrolita.
L'integrazione di approcci sperimentali e teorici ha portato a significativi progressi nel campo. Ad esempio, la progettazione razionale di elettrocatalizzatori per la scissione dell'acqua e la riduzione della CO₂ è stata guidata dalle intuizioni ottenute da questi sforzi combinati. Questi progressi non solo migliorano la nostra comprensione fondamentale dei processi elettrochimici, ma aprono anche la strada allo sviluppo di tecnologie energetiche più efficienti e sostenibili.
In sintesi, l'uso di tecniche avanzate in situ e non, unito alla modellazione teorica, ha rivoluzionato lo studio dei meccanismi elettrochimici a livello microscopico. Questo approccio interdisciplinare continua a guidare l'innovazione sia nella ricerca accademica che nelle applicazioni industriali.
Progressi nei test elettrochimici
I metodi elettrochimici tradizionali stanno subendo trasformazioni significative per soddisfare le esigenze contemporanee. Questi progressi sono guidati dalla necessità di migliorare la sensibilità del monitoraggio, di adattarsi a condizioni ambientali estreme e di integrare trattamenti matematici sofisticati. L'evoluzione delle tecniche di test elettrochimici non è un semplice miglioramento incrementale, ma un cambiamento di paradigma che colma il divario tra la comprensione teorica e l'applicazione pratica.
Una delle aree chiave di sviluppo è l'integrazione di modelli matematici avanzati. Questi modelli consentono previsioni e interpretazioni più precise dei fenomeni elettrochimici, in particolare nei sistemi complessi in cui i metodi tradizionali sono insufficienti. Ad esempio, l'incorporazione di algoritmi di apprendimento automatico ha permesso l'analisi e l'ottimizzazione in tempo reale dei processi elettrochimici, riducendo significativamente il tempo e le risorse necessarie per la sperimentazione.

Inoltre, l'adattabilità di questi metodi a condizioni estreme ha aperto nuove strade per la ricerca e l'applicazione. Che si tratti delle alte temperature dei processi industriali o delle basse temperature dell'esplorazione spaziale, le moderne tecniche elettrochimiche vengono adattate per garantire prestazioni affidabili ed efficienti. Questa adattabilità è fondamentale per i settori che vanno dalla produzione di energia alla scienza dei materiali, dove le condizioni possono variare notevolmente.
Oltre ai progressi matematici, anche i componenti hardware dei test elettrochimici hanno registrato notevoli miglioramenti. I sensori ad alta precisione e i sistemi automatizzati sono ormai comuni, consentendo il monitoraggio continuo e la raccolta dei dati. Questi sistemi non sono solo più precisi ma anche più facili da usare, rendendo i test elettrochimici avanzati accessibili a una più ampia gamma di ricercatori e industrie.
La sinergia tra questi progressi nella modellazione matematica, l'adattabilità all'ambiente e i miglioramenti hardware ha portato a una nuova era nei test elettrochimici. Questa era è caratterizzata da una maggiore precisione, efficienza e applicabilità, che apre la strada a progressi sia nella ricerca fondamentale che nelle applicazioni pratiche.
Applicazioni interdisciplinari
La versatilità dell'elettrochimica è evidente nelle sue ampie applicazioni in diversi ambiti scientifici e industriali. Una delle aree di applicazione più significative è l'elettrosintesi che sfrutta i processi elettrochimici per sintetizzare composti organici e inorganici complessi. Questo metodo è particolarmente utile nella produzione di prodotti farmaceutici, agrochimici e chimici speciali, in quanto offre un controllo preciso delle condizioni di reazione e riduce al minimo gli scarti.
I processi di elettrolisi sono un'altra pietra miliare dell'elettrochimica moderna e svolgono un ruolo cruciale nella produzione di prodotti chimici industriali essenziali come il cloro e l'idrossido di sodio nell'industria dei cloro-alcali. Inoltre, l'elettrolisi è fondamentale per l'estrazione di metalli come l'alluminio e per la generazione di idrogeno attraverso l'elettrolisi dell'acqua, che è fondamentale per le soluzioni energetiche sostenibili.
La protezione dalla corrosione è un'applicazione critica in cui i principi elettrochimici vengono impiegati per salvaguardare i metalli dal degrado. Tecniche come l'elettroplaccatura, la protezione anodica sacrificale e la protezione anodica sono ampiamente utilizzate per prolungare la durata di vita delle strutture metalliche in vari ambienti, da quelli marini agli impianti industriali.
L'elettrocatalisi rappresenta un campo all'avanguardia in cui l'elettrochimica si interseca con la catalisi per migliorare l'efficienza delle reazioni chimiche. Ciò è particolarmente importante per lo sviluppo delle celle a combustibile, che convertono l'energia chimica direttamente in energia elettrica con un'elevata efficienza e un impatto ambientale minimo.
Nel regno delle nuove fonti di energia l'elettrochimica è all'avanguardia nella ricerca sulle tecnologie avanzate delle batterie, tra cui le batterie agli ioni di litio e le batterie allo stato solido. Queste tecnologie sono essenziali per la transizione verso sistemi di energia rinnovabile, in quanto offrono densità energetiche più elevate e durate più lunghe rispetto alle batterie tradizionali.
La fotoelettrochimica fonde la fotochimica con l'elettrochimica, utilizzando l'energia luminosa per pilotare reazioni elettrochimiche. Questo campo è fondamentale per lo sviluppo delle celle solari e della scissione fotoelettrochimica dell'acqua, che può convertire la luce solare direttamente in idrogeno, un combustibile pulito e abbondante.
Infine, bioelettrochimica è una disciplina emergente che applica i principi elettrochimici ai sistemi biologici. Ciò include lo sviluppo di biosensori per la diagnostica medica e la bioelettrocatalisi per il biorisanamento e la produzione di bioenergia. Queste applicazioni evidenziano il profondo impatto dell'elettrochimica sulla salute umana e sulla sostenibilità ambientale.
Applicazioni pratiche dell'elettrochimica
Elettrolisi ed elettrosintesi
L'elettrolisi e l'elettrosintesi sono fondamentali per trasformare le materie prime in prodotti di valore, dando impulso a diversi processi industriali. L'industria industria dei cloro-alcali è una pietra miliare, che utilizza l'elettrolisi per produrre cloro e idrossido di sodio, essenziali per diversi processi chimici e settori produttivi. Questo processo non solo assicura una fornitura costante di questi prodotti chimici, ma sottolinea anche l'efficienza e la scalabilità dei metodi elettrochimici.
Nel campo dell elettrolisi dell'alluminio il processo di Hall-Héroult rimane indispensabile. Questo metodo, che prevede la riduzione elettrolitica dell'allumina disciolta in criolite fusa, è fondamentale per l'industria globale della produzione di alluminio. Il continuo perfezionamento e l'ottimizzazione di questo processo hanno ridotto significativamente il consumo energetico e l'impatto ambientale, rendendolo un modello di pratica industriale sostenibile.

L'elettrolisi dell'acqua ha suscitato grande attenzione, in particolare nel contesto dell'accumulo di energia rinnovabile e della produzione di idrogeno. Scindendo l'acqua in idrogeno e ossigeno mediante una corrente elettrica, questo processo offre una soluzione pulita e scalabile per la generazione di idrogeno combustibile, che può essere immagazzinato e utilizzato per alimentare diverse applicazioni, dai trasporti ai processi industriali.
L'elettrosintesi estende l'ambito delle applicazioni elettrochimiche, consentendo la sintesi di molecole organiche complesse e di prodotti farmaceutici. Questa tecnica consente un controllo preciso delle condizioni di reazione, con conseguente aumento della resa e della purezza dei prodotti. La versatilità dell'elettrosintesi è esemplificata dal suo utilizzo nella produzione di prodotti di chimica fine, agrochimici e materiali speciali, rafforzando la sua importanza nella moderna produzione chimica.
Queste applicazioni evidenziano collettivamente il potenziale di trasformazione dell'elettrolisi e dell'elettrosintesi, che guidano l'innovazione in diversi settori e contribuiscono agli obiettivi di sviluppo sostenibile.
Corrosione e protezione dei metalli
La corrosione dei metalli è un problema importante in diversi settori industriali, che comporta notevoli perdite economiche e rischi per la sicurezza. Per mitigare questi effetti, sono stati sviluppati e implementati diversi metodi avanzati. Tra questi, galvanotecnica si distingue come una tecnica versatile che non solo migliora l'aspetto estetico dei metalli, ma anche la loro resistenza alla corrosione. Depositando un sottile strato di un metallo più resistente alla corrosione sulla superficie del metallo di base, la galvanoplastica agisce come una barriera protettiva contro gli elementi ambientali.
Un altro metodo efficace è la la protezione con anodo sacrificale che prevede l'applicazione di un metallo più reattivo alla struttura da proteggere. Questo metallo sacrificale, spesso costituito da magnesio o zinco, si corrode in modo preferenziale, proteggendo così il metallo sottostante dalla corrosione. Questa tecnica è ampiamente utilizzata negli ambienti marini, dove i tassi di corrosione sono particolarmente elevati.
La protezione anodica è un altro approccio sofisticato che prevede la polarizzazione di un metallo a un potenziale tale da renderlo passivo, riducendo in modo significativo la sua velocità di corrosione. Questo metodo è particolarmente efficace per i metalli che possono formare uno strato di ossido stabile, come l'acciaio inossidabile. Controllando il potenziale, la protezione anodica può estendere la durata di vita delle infrastrutture critiche in settori come la lavorazione chimica e la raffinazione del petrolio.
Questi metodi, insieme ad altri come la protezione catodica e tecnologie di rivestimento formano un solido arsenale contro la corrosione dei metalli, garantendo la longevità e l'affidabilità delle strutture metalliche in diverse applicazioni.
Bioelettrochimica
La bioelettrochimica rappresenta un'affascinante intersezione tra biologia ed elettrochimica, con applicazioni che spaziano dalla diagnostica medica al monitoraggio ambientale. Una delle applicazioni più importanti è lo sviluppo di biosensori che sfruttano le molecole biologiche per rilevare e quantificare sostanze specifiche. Questi sensori sono fondamentali nella diagnostica medica, in quanto consentono di rilevare in modo rapido e preciso biomarcatori, ormoni e agenti patogeni. Ad esempio, i biosensori per il glucosio sono ampiamente utilizzati nella gestione del diabete, fornendo un monitoraggio in tempo reale dei livelli di glucosio nel sangue.
Oltre ai biosensori, bioelettrocatalisi è un'altra area critica della bioelettrochimica. Questo campo si concentra sull'utilizzo di enzimi o microrganismi come catalizzatori nelle reazioni elettrochimiche, migliorando l'efficienza e la specificità di questi processi. La bioelettrocatalisi ha implicazioni significative nelle energie rinnovabili, nel trattamento dei rifiuti e nei processi industriali. Ad esempio, le celle a combustibile microbiche utilizzano la bioelettrocatalisi per convertire i rifiuti organici direttamente in elettricità, offrendo una soluzione sostenibile per la produzione di energia e la gestione dei rifiuti.
| Applicazione | Descrizione | Esempio |
|---|---|---|
| Biosensori | Utilizzano molecole biologiche per il rilevamento e la quantificazione | Biosensori del glucosio per la gestione del diabete |
| Bioelettrocatalisi | Utilizza enzimi o microrganismi come catalizzatori nelle reazioni elettrochimiche | Celle a combustibile microbiche per la produzione di energia da rifiuti organici |
La sinergia tra principi biologici ed elettrochimici nella bioelettrochimica continua a guidare l'innovazione, promettendo nuovi strumenti e metodi sia per la ricerca scientifica che per le applicazioni pratiche.
Alimentatori chimici
Gli alimentatori chimici comprendono una serie di tecnologie diverse, ciascuna con caratteristiche e applicazioni uniche. Le categorie principali comprendono batterie primarie, batterie secondarie, batterie agli ioni di litio e celle a combustibile. Le batterie primarie, come quelle alcaline e allo zinco-carbone, sono progettate per l'uso singolo e si trovano comunemente in dispositivi di uso quotidiano come telecomandi e torce. Le batterie secondarie, o ricaricabili, comprendono quelle al piombo e al nichel-metallo idruro, che possono essere ricaricate più volte e sono quindi ideali per le applicazioni che richiedono un'alimentazione prolungata per lunghi periodi.
Le batterie agli ioni di litio hanno rivoluzionato l'elettronica portatile e i veicoli elettrici grazie alla loro elevata densità energetica, alla lunga durata e ai bassi tassi di autoscarica. Queste batterie sono composte da composti di litio come elettrodi e da un elettrolita non acquoso, offrendo un equilibrio tra costi, prestazioni e impatto ambientale.
Le celle a combustibile, invece, rappresentano un significativo progresso nella tecnologia dell'energia sostenibile. A differenza delle batterie, che immagazzinano energia chimicamente, le celle a combustibile generano elettricità attraverso la reazione elettrochimica di un combustibile, tipicamente l'idrogeno, con un ossidante, di solito l'ossigeno. Questo processo garantisce un'elevata efficienza, un basso livello di inquinamento e la possibilità di regolare la produzione di energia in base alla domanda. Le celle a combustibile sono particolarmente promettenti per applicazioni come i veicoli elettrici, i sistemi di alimentazione di riserva e persino l'esplorazione spaziale, dove l'energia affidabile e pulita è fondamentale.
| Tipo di batteria | Casi d'uso principali | Vantaggi principali |
|---|---|---|
| Batterie primarie | Dispositivi monouso (telecomandi, torce elettriche) | Economiche e ampiamente disponibili |
| Batterie secondarie | Dispositivi ricaricabili (telefoni, computer portatili) | Riutilizzabili, di lunga durata |
| Batterie agli ioni di litio | Elettronica portatile, veicoli elettrici | Alta densità energetica, bassa autoscarica |
| Celle a combustibile | Veicoli elettrici, energia di riserva, spazio | Alta efficienza, basso inquinamento, scalabilità |
Prodotti correlati
- Potenziostato da banco elettrochimico da laboratorio
- Elettrodo a disco d'oro
- Elettrodo a foglio d'oro per elettrochimica Elettrodo d'oro
- Supporto per elettrodi per esperimenti elettrochimici
- Cella Elettrolitica Tipo H Tripla Elettrochimica
Articoli correlati
- Guida completa all'elettrodo a disco rotante (RDE) negli studi elettrochimici
- L'Architettura della Certezza: Padroneggiare il Controllo nelle Celle Elettrolitiche Multifunzionali
- Guida definitiva agli analizzatori portatili di leghe: Caratteristiche, applicazioni e vantaggi
- Comprendere gli elettrodi di riferimento al calomelano saturo: Composizione, usi e considerazioni
- Rivoluzionare il controllo qualità: La guida definitiva agli analizzatori portatili di batterie al litio













