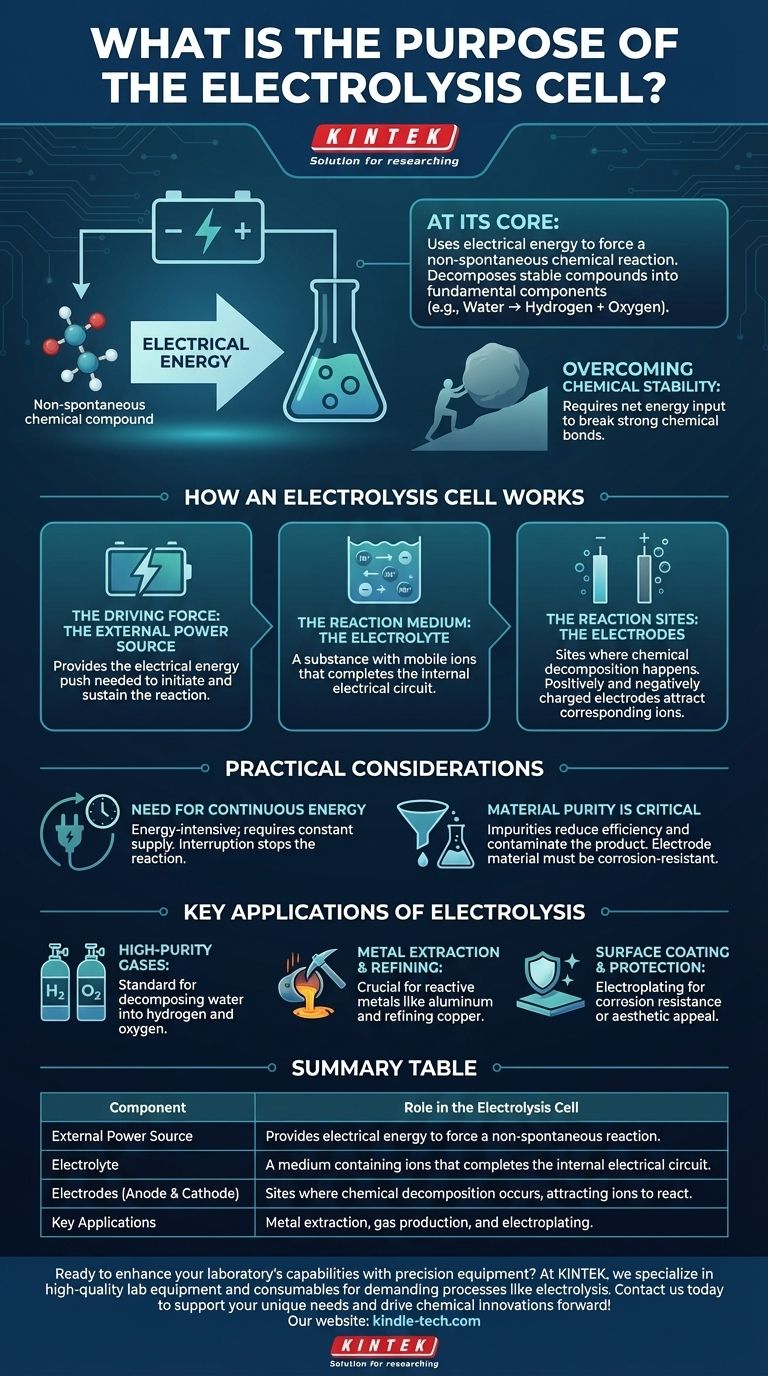
In sintesi, lo scopo di una cella elettrolitica è utilizzare l'energia elettrica per forzare una reazione chimica che non avverrebbe spontaneamente. Questo processo, noto come elettrolisi, ci permette di decomporre composti chimici stabili nei loro componenti più fondamentali, come la scomposizione dell'acqua in idrogeno e ossigeno.
Mentre molte reazioni chimiche rilasciano energia, alcuni dei più importanti processi industriali richiedono un apporto di energia per procedere. La cella elettrolitica è lo strumento fondamentale progettato per fornire questa energia, utilizzando l'elettricità per guidare reazioni non spontanee e creare preziosi prodotti chimici.

Come funziona una cella elettrolitica
Una cella elettrolitica è un sistema con tre componenti critici che lavorano insieme per ottenere un cambiamento chimico specifico. Comprendere ogni parte chiarisce l'intero processo.
La forza motrice: la fonte di alimentazione esterna
Una fonte di alimentazione esterna, come una batteria, fornisce l'energia elettrica necessaria. Questa energia agisce come la "spinta" necessaria per avviare e sostenere una reazione chimica che non è energeticamente favorevole. Senza questa tensione esterna, la decomposizione non avverrebbe.
Il mezzo di reazione: l'elettrolita
L'elettrolita è il mezzo che consente il flusso di particelle cariche (ioni). Non è semplicemente un liquido; è una sostanza, tipicamente una soluzione di sali disciolti in acqua o un sale fuso, che contiene ioni mobili. Questo movimento di ioni tra gli elettrodi è ciò che completa il circuito elettrico all'interno della cella.
I siti di reazione: gli elettrodi
Due elettrodi (un anodo e un catodo) sono immersi nell'elettrolita. Questi sono i siti fisici dove avviene effettivamente la decomposizione chimica. Quando viene applicata la fonte di alimentazione esterna, un elettrodo diventa caricato positivamente e l'altro negativamente, attirando gli ioni corrispondenti dall'elettrolita e forzandoli a reagire.
L'obiettivo fondamentale: forzare una reazione non spontanea
L'intero scopo della cella è superare la stabilità naturale di un composto. Questa è la differenza fondamentale tra una cella elettrolitica e una cella galvanica (come una batteria standard), che rilascia energia da una reazione spontanea.
Superare la stabilità chimica
Una reazione non spontanea è una che richiede un apporto netto di energia per procedere. Pensateci come spingere un masso in salita: non succederà da solo. L'energia elettrica fornita alla cella elettrolitica fornisce la forza necessaria per spingere questo "masso chimico" in salita, rompendo forti legami chimici.
Il significato di elettrolisi
Il nome stesso spiega la funzione. Deriva da "elettro", riferito all'elettricità, e dalla parola greca "lysis", che significa rompere o decomporre. La cella usa l'elettricità per rompere un composto.
Comprendere le considerazioni pratiche
Sebbene potente, l'elettrolisi non è priva di requisiti e limitazioni. La sua applicazione è una scelta ingegneristica deliberata basata su specifici compromessi.
La necessità di energia continua
L'elettrolisi è un processo ad alta intensità energetica. Richiede un'offerta costante e spesso sostanziale di elettricità per funzionare. Se l'alimentazione viene interrotta, la reazione si ferma immediatamente. Questo costo energetico è un fattore primario nella fattibilità economica dell'elettrolisi industriale.
La purezza del materiale è critica
La purezza dell'elettrolita è cruciale. Le impurità possono portare a reazioni secondarie indesiderate, riducendo l'efficienza del processo principale e contaminando il prodotto finale. Anche la scelta del materiale dell'elettrodo è vitale, poiché deve resistere all'ambiente corrosivo e non interferire con la reazione desiderata.
Applicazioni chiave dell'elettrolisi
L'applicazione giusta dipende interamente dal vostro obiettivo finale. La versatilità dell'elettrolisi la rende una pietra angolare della chimica e dell'industria moderna.
- Se il vostro obiettivo principale è produrre gas ad alta purezza: L'elettrolisi è il metodo standard per decomporre l'acqua (H₂O) in idrogeno e ossigeno eccezionalmente puri.
- Se il vostro obiettivo principale è l'estrazione e la raffinazione dei metalli: Il processo è indispensabile per produrre metalli altamente reattivi come l'alluminio dal suo minerale (bauxite) o raffinare il rame ad alta purezza.
- Se il vostro obiettivo principale è il rivestimento e la protezione delle superfici: Un processo elettrolitico simile, noto come galvanostegia, viene utilizzato per depositare un sottile strato di un metallo (come cromo o oro) su un altro per la resistenza alla corrosione o per l'aspetto estetico.
In definitiva, la cella elettrolitica è uno strumento fondamentale per convertire l'energia elettrica in un prezioso cambiamento chimico, permettendoci di creare sostanze che la natura non produrrebbe da sola.
Tabella riassuntiva:
| Componente | Ruolo nella cella elettrolitica |
|---|---|
| Fonte di alimentazione esterna | Fornisce energia elettrica per forzare una reazione non spontanea. |
| Elettrolita | Un mezzo contenente ioni che completa il circuito elettrico interno. |
| Elettrodi (Anodo e Catodo) | Siti dove avviene la decomposizione chimica, attirando gli ioni a reagire. |
| Applicazioni chiave | Estrazione di metalli (es. alluminio), produzione di gas (es. idrogeno) e galvanostegia. |
Pronti a migliorare le capacità del vostro laboratorio con attrezzature di precisione? Presso KINTEK, siamo specializzati nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità, su misura per processi esigenti come l'elettrolisi. Che stiate raffinando metalli, producendo gas ad alta purezza o conducendo galvanostegia, i nostri strumenti affidabili garantiscono efficienza e precisione. Contattateci oggi stesso per scoprire come KINTEK può supportare le esigenze uniche del vostro laboratorio e portare avanti le vostre innovazioni chimiche!
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica a Diffusione di Gas Cella di Reazione a Flusso Liquido
- Cella a Flusso Personalizzabile per la Riduzione di CO2 per Ricerca su NRR, ORR e CO2RR
- Custodia per batteria Li-Air per applicazioni di laboratorio
Domande frequenti
- Quali sono le procedure operative e le precauzioni di sicurezza durante un esperimento che utilizza una cella elettrolitica interamente in quarzo? Garantisci sicurezza e precisione nel tuo laboratorio
- Quali sono le specifiche di apertura standard per celle elettrolitiche interamente in quarzo sigillate e non sigillate? Ottimizza la tua configurazione elettrochimica
- Qual è la procedura corretta per la pulizia post-esperimento e la conservazione di una cella elettrolitica interamente in quarzo? Garantire longevità e riproducibilità
- Quali sono i volumi e le dimensioni disponibili per la cella elettrolitica interamente in quarzo? Trova la soluzione perfetta per il tuo laboratorio
- Quali precauzioni devono essere adottate durante la manipolazione e l'uso di una cella elettrolitica interamente in quarzo? Garantire prestazioni sicure, accurate e durature



















