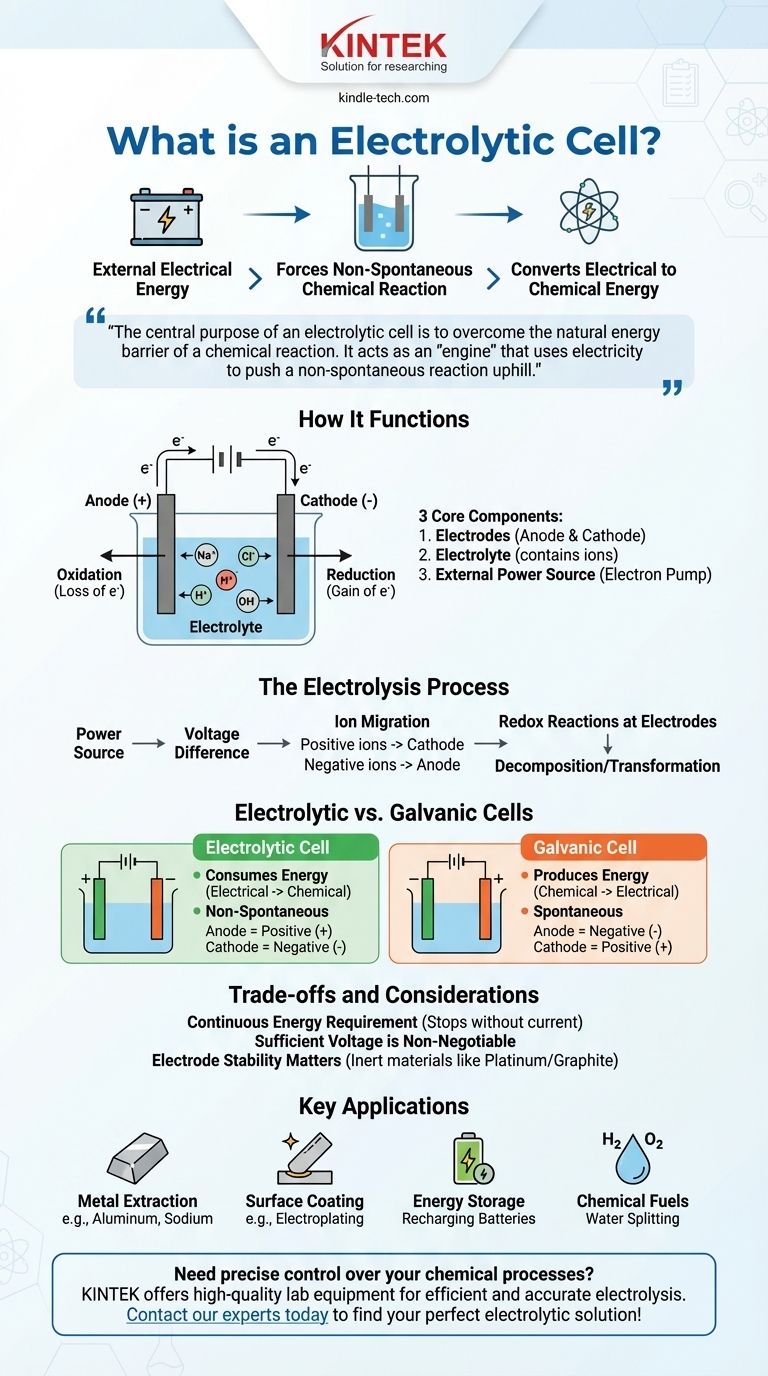
In sostanza, una cella elettrolitica è un dispositivo che utilizza energia elettrica da una fonte esterna, come una batteria, per forzare una reazione chimica che non avverrebbe da sola. Questo processo, noto come elettrolisi, converte l'energia elettrica in energia chimica immagazzinata decomponendo composti come acqua o sali fusi.
Lo scopo centrale di una cella elettrolitica è superare la barriera energetica naturale di una reazione chimica. Agisce come un "motore" che usa l'elettricità per spingere una reazione non spontanea "in salita", realizzando compiti come la separazione di elementi o la ricarica di una batteria.

Come funziona una cella elettrolitica
Per comprendere una cella elettrolitica, dobbiamo esaminare le sue parti essenziali e il processo che esse consentono. L'intero sistema è progettato per controllare il flusso di elettroni e ioni per guidare un cambiamento chimico specifico.
I tre componenti principali
Una cella elettrolitica è costruita da tre parti principali.
-
Elettrodi (Anodo e Catodo): Sono due conduttori metallici o elettronici che fungono da siti per la reazione chimica. L'anodo è l'elettrodo positivo dove avviene l'ossidazione (perdita di elettroni), e il catodo è l'elettrodo negativo dove avviene la riduzione (guadagno di elettroni).
-
Elettrolita: È una sostanza, tipicamente una soluzione liquida o un sale fuso, che contiene ioni in movimento libero. L'elettrolita consente il flusso di carica tra i due elettrodi, completando il circuito elettrico.
-
Fonte di alimentazione esterna: Questo è un componente cruciale, come una batteria o un alimentatore CC. Agisce come una "pompa di elettroni", tirando elettroni dall'anodo e spingendoli sul catodo.
Il processo di elettrolisi
La fonte di alimentazione crea una differenza di potenziale tra gli elettrodi.
Questo forza gli ioni nell'elettrolita a migrare. Gli ioni caricati positivamente si muovono verso il catodo negativo, e gli ioni caricati negativamente si muovono verso l'anodo positivo.
Agli elettrodi avvengono reazioni redox (trasferimento di carica). All'anodo, le sostanze perdono elettroni, e al catodo, le sostanze guadagnano elettroni, con conseguente decomposizione o trasformazione dei componenti dell'elettrolita.
La distinzione critica: celle elettrolitiche vs. galvaniche
Un punto comune di confusione è la differenza tra una cella elettrolitica e la sua controparte, la cella galvanica (o voltaica), che è ciò che tipicamente consideriamo una batteria standard.
Conversione di energia
Una cella elettrolitica consuma energia. Converte energia elettrica in energia chimica.
Una cella galvanica produce energia. Converte l'energia chimica immagazzinata in energia elettrica.
Spontaneità della reazione
La reazione in una cella elettrolitica non è spontanea. Richiede un apporto di energia esterno per procedere.
La reazione in una cella galvanica è spontanea. Avviene naturalmente, rilasciando energia nel processo.
Polarità degli elettrodi
In una cella elettrolitica, l'anodo è positivo e il catodo è negativo. Questo perché la fonte di alimentazione esterna detta la carica.
In una cella galvanica, l'anodo è negativo e il catodo è positivo. La reazione chimica spontanea stessa determina la carica.
Comprendere i compromessi e le considerazioni
Sebbene potenti, le celle elettrolitiche operano sotto vincoli specifici che è importante riconoscere.
Un requisito energetico continuo
La caratteristica principale di una cella elettrolitica è la sua dipendenza da una fonte di alimentazione esterna. Il processo di elettrolisi si interrompe nel momento in cui la corrente elettrica viene rimossa.
Una tensione sufficiente è non negoziabile
La tensione esterna applicata deve essere sufficientemente alta per superare la resistenza naturale della reazione non spontanea. Se la tensione è troppo bassa, non avverrà alcun cambiamento chimico.
La stabilità degli elettrodi è importante
Gli elettrodi stessi devono essere scelti con cura. In molti processi, sono fatti di materiali inerti come platino o grafite che facilitano la reazione senza essere consumati. In altre applicazioni, il materiale dell'elettrodo viene scelto intenzionalmente per partecipare alla reazione, come si vede in alcuni tipi di purificazione.
Applicazioni chiave delle celle elettrolitiche
La capacità di forzare reazioni chimiche conferisce alle celle elettrolitiche un ruolo centrale nell'industria e nella tecnologia.
- Se il tuo obiettivo principale è produrre elementi puri: L'elettrolisi viene utilizzata per estrarre metalli come l'alluminio dal suo minerale (bauxite) o per produrre sodio e cloro gassoso dal cloruro di sodio fuso.
- Se il tuo obiettivo principale è la rivestitura superficiale: Il processo di galvanoplastica utilizza una cella elettrolitica per depositare un sottile strato di un metallo (come cromo o oro) su un altro per protezione o decorazione.
- Se il tuo obiettivo principale è l'accumulo di energia: La ricarica di una batteria implica il suo funzionamento come cella elettrolitica. Il caricabatterie esterno forza gli ioni a tornare al loro stato originale, immagazzinando energia per un uso successivo.
- Se il tuo obiettivo principale è creare combustibili chimici: Le celle elettrolitiche possono scindere l'acqua (H₂O) in idrogeno gassoso e ossigeno gassoso, con l'idrogeno che funge da fonte di combustibile pulito.
Applicando l'energia elettrica con precisione, una cella elettrolitica ci offre un controllo diretto sulle trasformazioni chimiche.
Tabella riassuntiva:
| Caratteristica | Cella elettrolitica | Cella galvanica (Batteria) |
|---|---|---|
| Conversione di energia | Converte energia elettrica in energia chimica | Converte energia chimica in energia elettrica |
| Tipo di reazione | Non spontanea (richiede alimentazione esterna) | Spontanea (avviene naturalmente) |
| Carica dell'anodo | Positiva | Negativa |
| Funzione principale | Guidare reazioni chimiche desiderate (es. galvanoplastica) | Generare elettricità |
Hai bisogno di un controllo preciso sui tuoi processi chimici? Le attrezzature da laboratorio di alta qualità di KINTEK, inclusi alimentatori affidabili ed elettrodi durevoli, sono essenziali per un'elettrolisi efficiente e accurata. Che la tua applicazione sia la galvanoplastica, la purificazione dei metalli o la ricerca sull'accumulo di energia, i nostri materiali di consumo e strumenti sono progettati per prestazioni superiori. Contatta oggi i nostri esperti per trovare la soluzione elettrolitica perfetta per le esigenze del tuo laboratorio!
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Bagno d'acqua a doppio strato a cinque porte Cella elettrolitica elettrochimica
Domande frequenti
- Quali sono i componenti standard della cella elettrolitica a cinque porte con bagno d'acqua? Padroneggia lo strumento di precisione per l'analisi elettrochimica
- Quale precauzione generale dovrebbe essere presa quando si maneggia la cella elettrolitica? Garantire risultati di laboratorio sicuri e accurati
- Come dovrebbe essere mantenuto il corpo di una cella elettrolitica per garantirne la longevità? Estendi la vita utile della tua attrezzatura
- Qual è il modo corretto di maneggiare una cella elettrolitica con bagno d'acqua a cinque porte? Garantire esperimenti elettrochimici accurati e sicuri
- Come si pulisce la cella elettrolitica a cinque porte a bagno d'acqua per la manutenzione? Una guida passo-passo per risultati affidabili



















