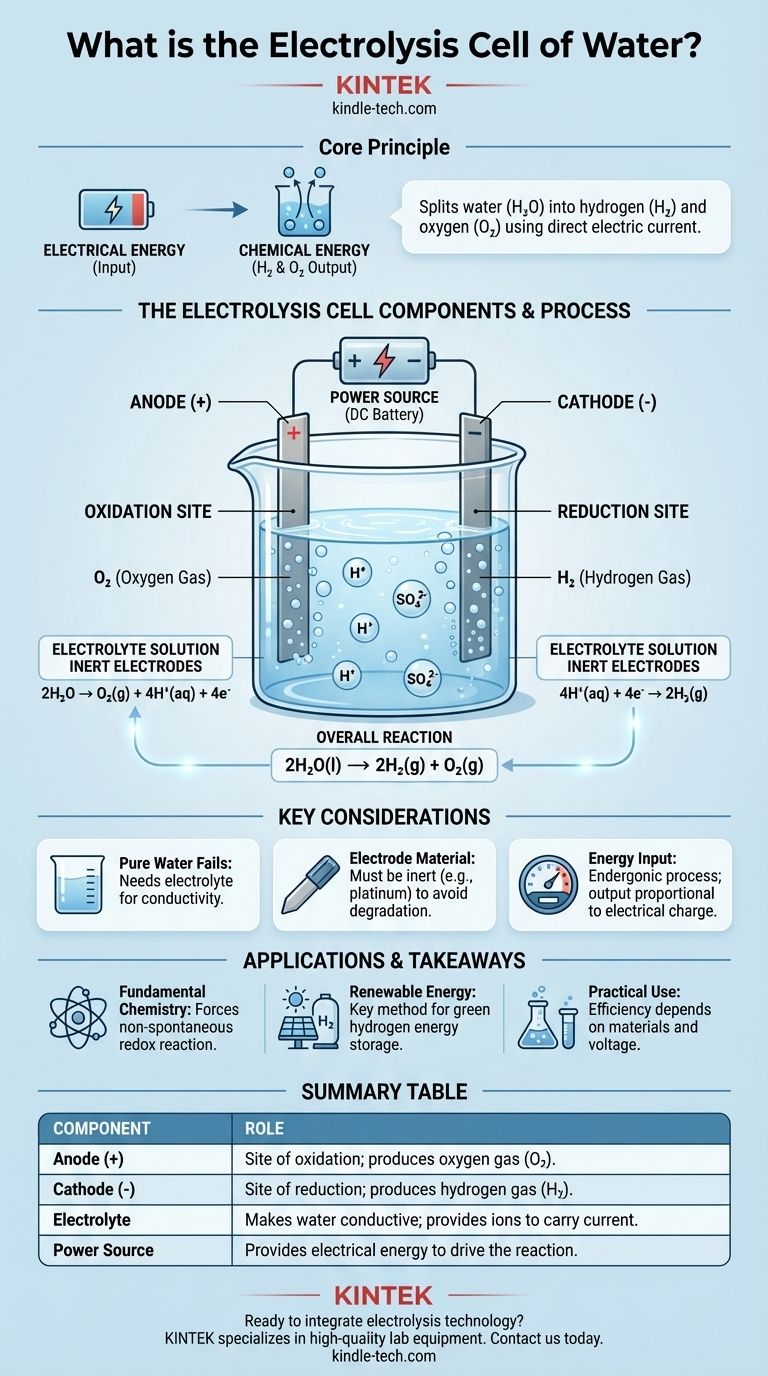
In sintesi, una cella elettrolitica dell'acqua è un dispositivo che utilizza energia elettrica per scindere l'acqua (H₂O) nei suoi elementi costitutivi: idrogeno gassoso (H₂) e ossigeno gassoso (O₂). Questo avviene facendo passare una corrente elettrica continua attraverso l'acqua che contiene una piccola quantità di un elettrolita, forzando un cambiamento chimico che non avverrebbe spontaneamente. I componenti fondamentali sono due elettrodi (un anodo e un catodo) immersi nell'elettrolita e collegati a una fonte di alimentazione esterna.
Lo scopo centrale di una cella elettrolitica è convertire l'energia elettrica in energia chimica. Utilizza una tensione esterna per guidare una reazione redox non spontanea, immagazzinando efficacemente l'energia in ingresso nei legami chimici delle molecole di idrogeno e ossigeno risultanti.

I Componenti Chiave e i Loro Ruoli
Una cella elettrolitica per l'acqua opera attraverso l'interazione precisa di tre parti fondamentali: gli elettrodi, l'elettrolita e la fonte di alimentazione. Ciascuno svolge un ruolo distinto e critico nel processo.
Gli Elettrodi: Anodo e Catodo
La cella contiene due elettrodi, che sono conduttori attraverso i quali l'elettricità entra ed esce dalla soluzione. Questi sono tipicamente realizzati con un materiale inerte, come il platino o la grafite, per garantire che facilitino la reazione senza essere consumati da essa.
L'anodo è l'elettrodo positivo. Questo è il sito dell'ossidazione, dove le sostanze perdono elettroni.
Il catodo è l'elettrodo negativo. Questo è il sito della riduzione, dove le sostanze acquisiscono elettroni.
L'Elettrolita: Rendere l'Acqua Conduttiva
L'acqua pura è un pessimo conduttore di elettricità perché contiene troppo pochi ioni liberi per trasportare efficacemente una corrente.
Per risolvere questo problema, viene aggiunta una piccola quantità di un elettrolita, come l'acido solforico (H₂SO₄). L'elettrolita si dissolve nell'acqua e fornisce ioni mobili (in questo caso, H⁺ e SO₄²⁻) che possono trasportare la carica tra gli elettrodi, completando il circuito elettrico.
La Fonte di Alimentazione: Guidare la Reazione
La scissione dell'acqua è una reazione endergonica, il che significa che richiede un apporto di energia per avvenire. L'acqua è stabile e non si decompone spontaneamente.
Una fonte di alimentazione esterna, come una batteria o un alimentatore CC, fornisce la tensione necessaria. Questa pressione elettrica "spinge" gli elettroni nel catodo e li "attira" dall'anodo, forzando la decomposizione chimica dell'acqua.
Il Processo Chimico: Come l'Acqua Viene Scissa
Il processo complessivo è una reazione redox (riduzione-ossidazione), divisa in due distinte semireazioni che avvengono a ciascun elettrodo.
Ossidazione all'Anodo (+)
All'anodo positivo, le molecole d'acqua vengono ossidate. Cedono i loro elettroni, che poi fluiscono fuori dalla cella nel circuito esterno.
Questa reazione produce ossigeno gassoso (O₂) e ioni idrogeno (H⁺). La semireazione è: 2H₂O → O₂(g) + 4H⁺(aq) + 4e⁻
Riduzione al Catodo (-)
Gli ioni idrogeno (H⁺) generati all'anodo (e presenti dall'elettrolita acido) sono attratti dal catodo negativo.
Al catodo, questi ioni acquisiscono elettroni che fluiscono dal circuito esterno. Questa reazione di riduzione produce idrogeno gassoso (H₂). La semireazione è: 4H⁺(aq) + 4e⁻ → 2H₂(g)
La Reazione Complessiva
Quando si combinano le due semireazioni, gli elettroni e gli ioni idrogeno su entrambi i lati si annullano, rivelando il semplice ed elegante risultato complessivo dell'elettrolisi dell'acqua.
Il cambiamento chimico netto è: 2H₂O(l) → 2H₂(g) + O₂(g). Per ogni due molecole d'acqua scisse, vengono prodotte due molecole di idrogeno gassoso e una molecola di ossigeno gassoso.
Comprendere le Considerazioni Chiave
Sebbene il concetto sia semplice, diversi fattori sono critici affinché la cella funzioni correttamente ed efficientemente. Comprendere queste limitazioni rivela la vera natura del processo.
Perché l'Acqua Pura Fallisce
Senza un elettrolita, la resistenza dell'acqua è estremamente elevata. L'applicazione di una tensione comporterebbe un flusso di corrente trascurabile e, di conseguenza, praticamente nessuna produzione di idrogeno o ossigeno. L'elettrolita non viene consumato; il suo unico compito è agire da portatore di carica.
Il Materiale dell'Elettrodo è Cruciale
L'uso di elettrodi inerti come il platino è essenziale. Se si utilizzasse un metallo reattivo come lo zinco o il rame per l'anodo, l'anodo stesso si ossiderebbe e si dissolverebbe nella soluzione invece dell'acqua. Ciò produrrebbe prodotti diversi e non intenzionali e distruggerebbe l'elettrodo.
L'Input Energetico Determina l'Output
L'elettrolisi non è una fonte di energia gratuita; è un processo di conversione energetica. La quantità di idrogeno e ossigeno prodotta è direttamente proporzionale alla quantità di carica elettrica che attraversa la cella. Ci vuole una quantità significativa di energia elettrica per produrre una piccola quantità di idrogeno gassoso.
Fare la Scelta Giusta per il Tuo Obiettivo
Comprendere la cella elettrolitica è prezioso per diverse discipline. Il tuo risultato dipende dal tuo obiettivo sottostante.
- Se il tuo obiettivo principale è la chimica fondamentale: Considera questo come una perfetta dimostrazione di come l'energia elettrica possa forzare una reazione redox non spontanea, separando un composto stabile nei suoi elementi.
- Se il tuo obiettivo principale è l'energia rinnovabile: Riconosci l'elettrolisi come un metodo chiave per l'accumulo di energia, convertendo l'elettricità in eccesso da fonti come il solare o l'eolico in combustibile idrogeno.
- Se il tuo obiettivo principale è l'applicazione pratica: Ricorda che l'efficienza, la velocità e i prodotti dell'elettrolisi dipendono interamente dai materiali specifici utilizzati: l'elettrolita, il materiale dell'elettrodo e la tensione applicata.
In definitiva, l'elettrolisi dell'acqua è un processo potente che utilizza l'elettricità per sbloccare l'energia chimica immagazzinata in una semplice molecola.
Tabella Riepilogativa:
| Componente | Ruolo nella Cella Elettrolitica |
|---|---|
| Anodo (Elettrodo Positivo) | Sito di ossidazione; produce ossigeno gassoso (O₂). |
| Catodo (Elettrodo Negativo) | Sito di riduzione; produce idrogeno gassoso (H₂). |
| Elettrolita | Rende l'acqua conduttiva; fornisce ioni per trasportare la corrente. |
| Fonte di Alimentazione | Fornisce l'energia elettrica per guidare la reazione non spontanea. |
Pronto a integrare la tecnologia di elettrolisi nei tuoi flussi di lavoro di laboratorio? KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità per processi chimici avanzati. Che tu stia sviluppando nuove soluzioni per l'accumulo di energia o conducendo ricerche fondamentali, la nostra esperienza ti garantisce l'attrezzatura affidabile di cui hai bisogno. Contatta il nostro team oggi stesso per discutere come possiamo supportare le tue specifiche esigenze di laboratorio.
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Bagno d'acqua a doppio strato a cinque porte Cella elettrolitica elettrochimica
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrochimica Elettrolitica a Diffusione di Gas Cella di Reazione a Flusso Liquido
Domande frequenti
- Qual è lo scopo della struttura a doppio strato nella cella elettrolitica di tipo H? Ottenere un controllo termico preciso
- Quali sono le specifiche standard di apertura per una cella elettrolitica a membrana scambiabile di tipo H? Porte asimmetriche per un'elettrochimica precisa
- Cos'è una cella di tipo H? Una guida alle celle elettrochimiche divise per esperimenti accurati
- Qual è la struttura complessiva della cella elettrolitica a bagno d'acqua ottico a doppio strato di tipo H? Design di precisione per esperimenti controllati
- Qual è la struttura di una cella elettrolitica a membrana scambiabile di tipo H? Una guida alla separazione elettrochimica precisa



















