Sebbene la tua domanda menzioni due celle elettrolitiche, la distinzione fondamentale in elettrochimica è tra una cella elettrolitica e una cella galvanica (nota anche come cella voltaica). Una cella galvanica genera energia elettrica da una reazione chimica spontanea, come una comune batteria. Al contrario, una cella elettrolitica utilizza una fonte esterna di energia elettrica per forzare l'accadimento di una reazione chimica non spontanea.
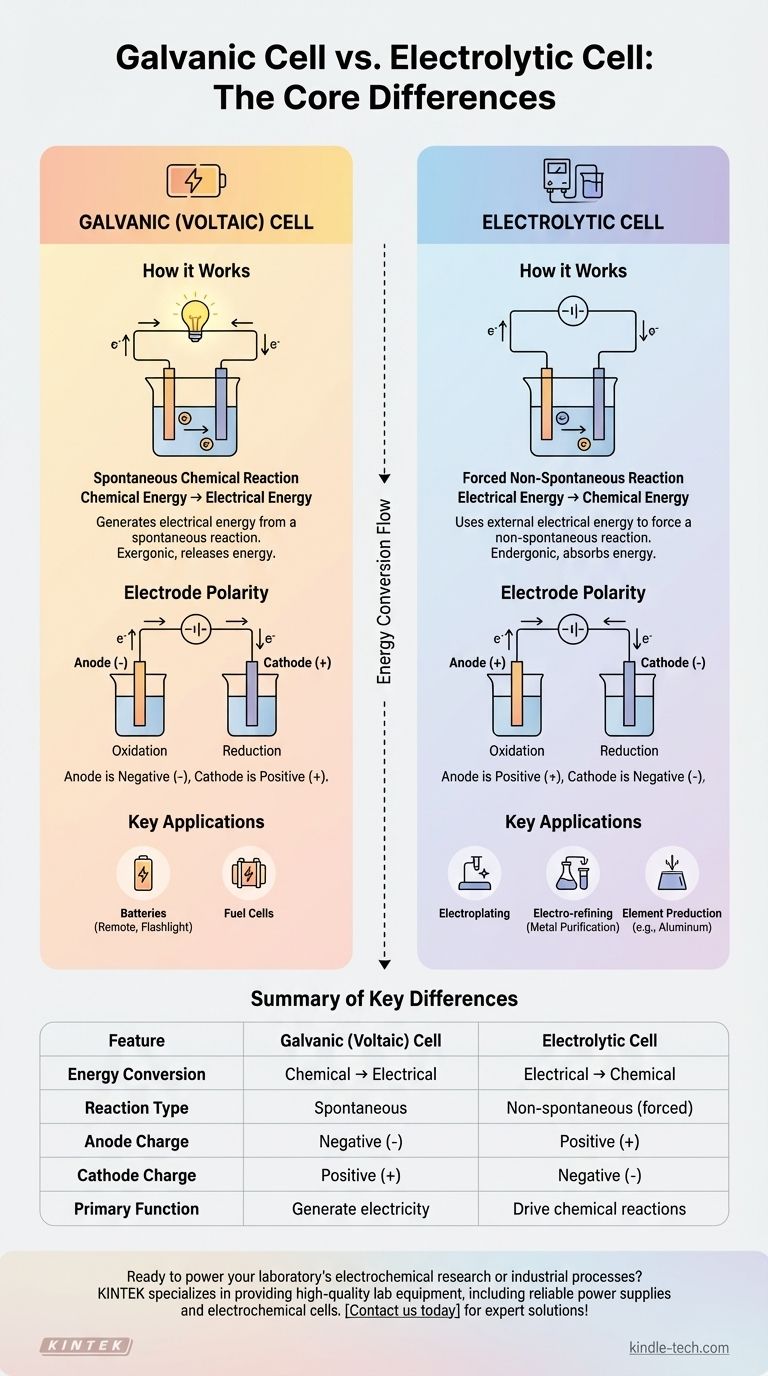
La differenza fondamentale si riduce alla conversione energetica. Una cella galvanica converte l'energia chimica immagazzinata in energia elettrica, mentre una cella elettrolitica fa esattamente l'opposto, convertendo l'energia elettrica in energia chimica per produrre le sostanze desiderate.

Come funzionano le celle galvaniche (voltaiche)
Una cella galvanica è un sistema autonomo che produce elettricità. Pensa a qualsiasi batteria standard che usi in un telecomando o in una torcia.
Reazioni chimiche spontanee
Il motore di una cella galvanica è una reazione redox (riduzione-ossidazione) spontanea. Ciò significa che la reazione chimica avviene naturalmente senza alcun apporto di energia esterna, rilasciando energia nel processo.
Conversione energetica: da chimica a elettrica
L'energia rilasciata dalla reazione spontanea spinge gli elettroni attraverso un circuito esterno, creando una corrente elettrica. Trasforma efficacemente l'energia potenziale chimica immagazzinata in energia elettrica utilizzabile.
Polarità degli elettrodi
In una cella galvanica, l'anodo è l'elettrodo negativo dove avviene l'ossidazione, e il catodo è l'elettrodo positivo dove avviene la riduzione. Gli elettroni fluiscono dall'anodo negativo al catodo positivo.
Come funzionano le celle elettrolitiche
Una cella elettrolitica viene utilizzata per guidare cambiamenti chimici che non avverrebbero da soli. Questo processo è noto come elettrolisi.
Forzare reazioni non spontanee
Queste celle sono progettate per forzare l'avanzamento di una reazione non spontanea. Ad esempio, l'acqua non si scompone spontaneamente in idrogeno e ossigeno; richiede energia per essere separata.
Il ruolo di una fonte di alimentazione esterna
Per guidare questa reazione, una cella elettrolitica deve essere collegata a una fonte di alimentazione esterna, come una batteria o un alimentatore CC. Questa fonte fornisce l'energia necessaria per superare la resistenza naturale della reazione.
La funzione dell'elettrolita
La cella contiene un elettrolita, che è tipicamente un sale fuso o una soluzione salina. Questa sostanza contiene ioni mobili che sono attratti dagli elettrodi, consentendo alle reazioni chimiche di avvenire e completando il circuito elettrico.
Applicazioni nell'industria
Questo processo è fondamentale per molte applicazioni industriali, tra cui l'elettrodeposizione (rivestimento di un oggetto con un sottile strato di metallo), l'elettroraffinazione per purificare metalli come il rame e la produzione di elementi puri come l'alluminio dal minerale di bauxite.
Comprendere le differenze fondamentali
Confrontare queste due celle fianco a fianco rivela la loro natura opposta. Sono due facce della stessa medaglia elettrochimica.
Flusso di energia e spontaneità
Una cella galvanica è esoergonica, il che significa che rilascia energia da una reazione spontanea. Una cella elettrolitica è endoergonica, il che significa che assorbe energia per guidare una reazione non spontanea.
Inversione della polarità degli elettrodi
Questo è un punto critico di distinzione. Mentre l'ossidazione avviene sempre all'anodo e la riduzione al catodo, le loro cariche sono invertite.
- In una cella galvanica: l'anodo è negativo (-), il catodo è positivo (+).
- In una cella elettrolitica: l'anodo è positivo (+), il catodo è negativo (-).
Questa inversione avviene perché la fonte di alimentazione esterna in una cella elettrolitica detta il flusso di elettroni, annullando la tendenza naturale del sistema chimico.
Fare la scelta giusta per il tuo obiettivo
Comprendere quale cella utilizzare dipende interamente dal fatto che il tuo obiettivo sia generare energia o creare un prodotto chimico.
- Se il tuo obiettivo principale è generare energia da un processo chimico: Stai descrivendo una cella galvanica (voltaica), che è il principio alla base di tutte le batterie.
- Se il tuo obiettivo principale è utilizzare l'energia per creare una sostanza: Hai bisogno di una cella elettrolitica, che è la base per l'elettrodeposizione industriale, la raffinazione e la produzione di elementi.
- Se il tuo obiettivo principale è comprendere l'elettrochimica di base: Ricorda che le celle galvaniche rilasciano energia spontaneamente, mentre le celle elettrolitiche richiedono energia per forzare una reazione.
In definitiva, la direzione della conversione energetica è il fattore più importante che definisce e separa queste due fondamentali celle elettrochimiche.
Tabella riassuntiva:
| Caratteristica | Cella Galvanica (Voltaica) | Cella Elettrolitica |
|---|---|---|
| Conversione energetica | Chimica → Elettrica | Elettrica → Chimica |
| Tipo di reazione | Spontanea | Non spontanea (forzata) |
| Carica dell'anodo | Negativa (-) | Positiva (+) |
| Carica del catodo | Positiva (+) | Negativa (-) |
| Funzione principale | Generare elettricità (es. batterie) | Guidare reazioni chimiche (es. elettrodeposizione, raffinazione) |
Pronto ad alimentare la ricerca elettrochimica o i processi industriali del tuo laboratorio? KINTEK è specializzata nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità, inclusi alimentatori affidabili e celle elettrochimiche su misura per le tue esigenze specifiche. Che tu stia sviluppando nuove tecnologie per batterie o ottimizzando sistemi di elettrodeposizione, la nostra esperienza ti garantisce gli strumenti giusti per il successo. Contattaci oggi per discutere come possiamo supportare i tuoi progetti con attrezzature di precisione e soluzioni esperte!
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Bagno d'acqua a doppio strato a cinque porte Cella elettrolitica elettrochimica
Domande frequenti
- Come si possono prevenire le perdite quando si utilizza una cella elettrolitica a bagno d'acqua a cinque porte? Garantire un setup elettrochimico affidabile e sicuro
- Come si pulisce la cella elettrolitica a cinque porte a bagno d'acqua per la manutenzione? Una guida passo-passo per risultati affidabili
- Quale precauzione generale dovrebbe essere presa quando si maneggia la cella elettrolitica? Garantire risultati di laboratorio sicuri e accurati
- Come si deve far funzionare una cella elettrolitica a bagno d'acqua a cinque porte durante un esperimento? Padroneggiare il controllo preciso per risultati affidabili
- Quali sono i componenti standard della cella elettrolitica a cinque porte con bagno d'acqua? Padroneggia lo strumento di precisione per l'analisi elettrochimica



















