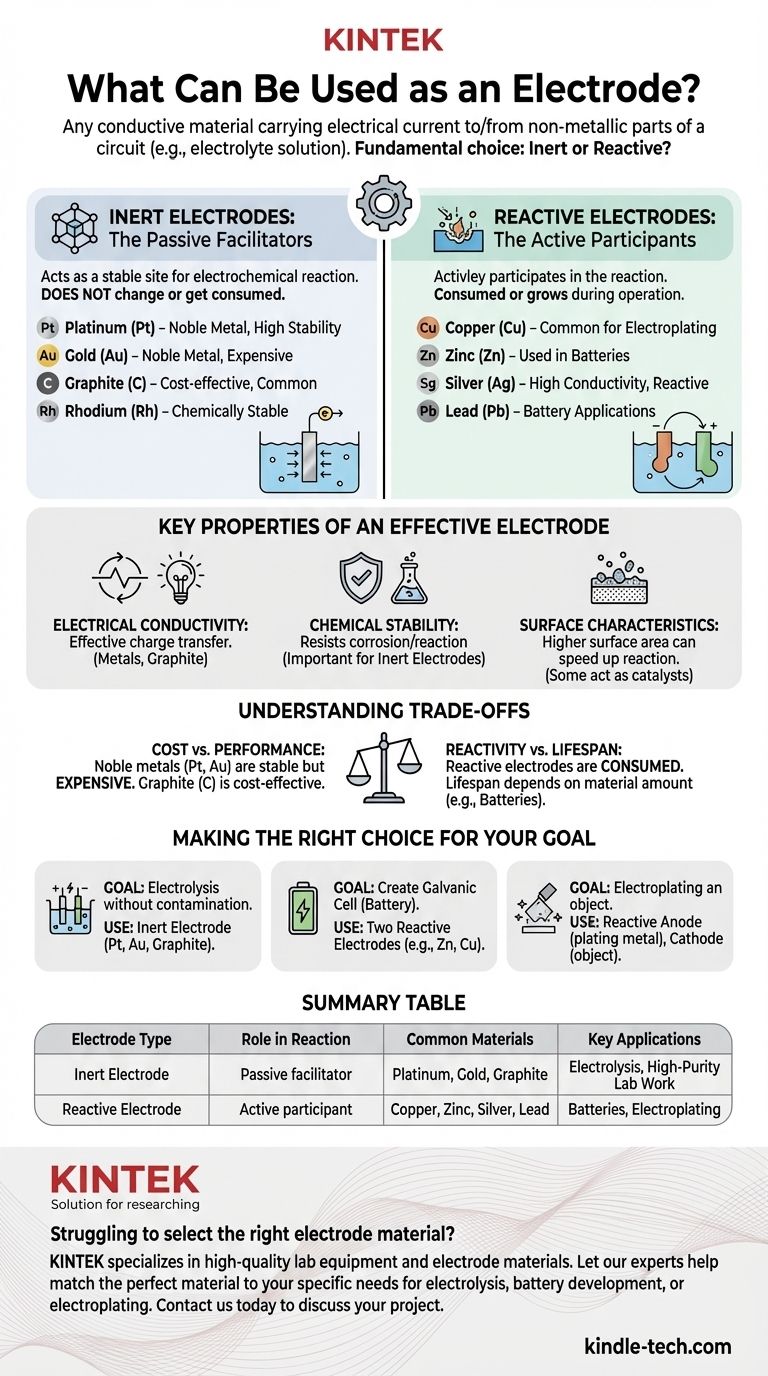
In breve, un elettrodo è qualsiasi materiale conduttivo che trasporta una corrente elettrica all'interno o all'esterno di una parte non metallica di un circuito, come una soluzione elettrolitica. Gli elettrodi sono ampiamente classificati in due categorie: elettrodi inerti, che non partecipano alla reazione chimica, ed elettrodi reattivi, che lo fanno. Esempi comuni includono metalli come platino, oro, rame e zinco, così come non metalli come la grafite (carbonio).
La scelta di un elettrodo è una decisione di progettazione critica in qualsiasi sistema elettrochimico. La scelta fondamentale non è solo "quale materiale conduce l'elettricità", ma se è necessario un materiale che rimanga inalterato (inerte) o uno che partecipi attivamente alla reazione chimica (reattivo).

I due tipi fondamentali di elettrodi
La distinzione più importante nella scelta di un materiale per elettrodi è il suo ruolo nella reazione chimica desiderata. Questo separa tutti i potenziali materiali in due gruppi principali.
Elettrodi inerti: i facilitatori passivi
Un elettrodo inerte agisce come un sito stabile e non reattivo per l'avvenimento di una reazione elettrochimica. Il suo compito è semplicemente quello di condurre elettroni verso o dall'elettrolita.
Il materiale stesso non cambia, non viene consumato o non si dissolve nella soluzione. È semplicemente una superficie.
Per questo motivo, gli elettrodi inerti devono essere fatti di materiali chimicamente stabili nell'elettrolita specifico utilizzato. Le scelte comuni includono metalli nobili e carbonio.
Esempi di elettrodi inerti:
- Platino (Pt)
- Oro (Au)
- Grafite (C)
- Rodio (Rh)
Elettrodi reattivi: i partecipanti attivi
Un elettrodo reattivo è un partecipante attivo nella reazione elettrochimica. Viene ossidato (sciogliendosi nell'elettrolita) o è il prodotto della riduzione (depositandosi sulla superficie).
Questi materiali sono scelti specificamente per la loro capacità di reagire in modo controllato. Questo è il principio alla base delle batterie e della galvanoplastica.
L'elettrodo stesso viene consumato o cresce durante il funzionamento della cella elettrochimica.
Esempi di elettrodi reattivi:
- Rame (Cu)
- Zinco (Zn)
- Argento (Ag)
- Piombo (Pb)
Proprietà chiave di un elettrodo efficace
Oltre alla classificazione di base, diverse proprietà determinano quanto bene un materiale funzionerà come elettrodo per uno scopo specifico.
Conducibilità elettrica
Questo è il requisito più fondamentale. Il materiale deve essere un conduttore efficace di elettricità per trasferire la carica tra il circuito esterno e l'elettrolita. Metalli e grafite sono scelte eccellenti per questo motivo.
Stabilità chimica
Affinché un elettrodo sia considerato inerte, deve resistere alla corrosione o alla reazione con l'elettrolita e qualsiasi sostanza prodotta durante la reazione. Per questo motivo, metalli nobili come platino e oro sono molto apprezzati per queste applicazioni.
Caratteristiche della superficie
La reazione avviene sulla superficie dell'elettrodo. Un materiale con una superficie maggiore può spesso supportare una velocità di reazione più rapida. Inoltre, alcuni materiali, come il platino, possono agire da catalizzatori, abbassando l'energia richiesta per l'avanzamento di una reazione.
Comprendere i compromessi
L'elettrodo teoricamente "migliore" non è sempre il più pratico da usare. Le applicazioni nel mondo reale richiedono un equilibrio tra prestazioni e altri fattori.
Costo vs. Prestazioni
I metalli nobili come il platino e l'oro sono elettrodi inerti eccezionali grazie alla loro estrema stabilità, ma sono molto costosi.
Per molte applicazioni, la grafite offre un'alternativa molto più economica. Sebbene possa essere meno durevole o cataliticamente attiva del platino, il suo basso costo la rende la scelta dominante per innumerevoli processi industriali.
Reattività vs. Durata
Per definizione, gli elettrodi reattivi vengono consumati nel tempo. Questa è una funzione necessaria in applicazioni come le celle galvaniche (batterie), dove il consumo dell'elettrodo genera la corrente elettrica.
Ciò significa che la durata del dispositivo è direttamente legata alla quantità di materiale elettrodico reattivo disponibile. La scelta del materiale determina la tensione della cella e la sua longevità.
Fare la scelta giusta per il tuo obiettivo
La selezione del materiale dell'elettrodo dovrebbe essere guidata interamente dall'obiettivo della tua cella elettrochimica.
- Se il tuo obiettivo principale è l'elettrolisi senza contaminazione: Hai bisogno di un elettrodo inerte. Usa platino o oro per lavori di laboratorio ad alta purezza, o grafite (carbonio) come alternativa economica.
- Se il tuo obiettivo principale è creare una cella galvanica (una batteria): Hai bisogno di due elettrodi reattivi diversi. Usa materiali come zinco e rame, la cui differenza di potenziale chimico guida la corrente elettrica.
- Se il tuo obiettivo principale è la galvanoplastica di un oggetto: Il tuo anodo (elettrodo positivo) dovrebbe essere un elettrodo reattivo fatto del metallo che vuoi placcare (ad esempio, argento), e il tuo catodo (elettrodo negativo) sarà l'oggetto stesso.
In definitiva, l'elettrodo giusto è quello le cui proprietà chimiche e fisiche sono precisamente abbinate alla funzione specifica che deve svolgere all'interno della tua cella elettrochimica.
Tabella riassuntiva:
| Tipo di elettrodo | Ruolo nella reazione | Materiali comuni | Applicazioni chiave |
|---|---|---|---|
| Elettrodo inerte | Facilitatore passivo; non reagisce | Platino, Oro, Grafite | Elettrolisi, Lavori di laboratorio ad alta purezza |
| Elettrodo reattivo | Partecipante attivo; viene consumato o formato | Rame, Zinco, Argento, Piombo | Batterie, Galvanoplastica |
Hai difficoltà a selezionare il materiale elettrodico giusto per la tua applicazione? Le prestazioni del tuo processo elettrochimico dipendono da questa scelta critica. KINTEK è specializzata nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità, inclusa una vasta gamma di materiali per elettrodi come platino, grafite e metalli reattivi. I nostri esperti possono aiutarti a trovare il materiale perfetto per le tue esigenze specifiche—che si tratti di elettrolisi, sviluppo di batterie o galvanoplastica—garantendo risultati e efficienza ottimali. Contattaci oggi per discutere il tuo progetto e lascia che KINTEK sia il tuo partner di precisione. Mettiti in contatto tramite il nostro Modulo di Contatto
Guida Visiva
Prodotti correlati
- Elettrodo a foglio di platino per applicazioni di laboratorio e industriali
- Elettrodo a disco rotante in platino per applicazioni elettrochimiche
- Elettrodo Elettrochimico in Grafite, Elettrodo a Disco e Asta in Grafite
- Elettrodo Ausiliario in Platino per Uso di Laboratorio
- Elettrodo a disco d'oro
Domande frequenti
- Qual è il materiale comunemente usato come anodo? Scegliere tra elettrodi inerti e attivi
- Quali sono le procedure di pulizia specifiche per la manutenzione di un portacampioni? Garantisci l'integrità dei dati con un protocollo comprovato
- Qual è la logica alla base dell'uso di catodi in lana d'acciaio? Aumentare l'efficienza nel recupero dei metalli da soluzioni diluite
- Come si prepara l'attrezzatura per la lucidatura di un elettrodo? Ottieni una finitura a specchio impeccabile per un'elettrochimica affidabile
- Perché un foglio di platino (Pt) viene utilizzato come elettrodo di contro in un sistema di test elettrochimico a tre elettrodi?
- Come si deve regolare il supporto per elettrodi in PTFE per adattarsi alla cella elettrolitica? Garantisci la Massima Stabilità per i Tuoi Esperimenti
- Quali sono i vantaggi dell'utilizzo di schiuma di nichel o rete di nichel ad alta porosità? Potenzia le prestazioni del tuo MEC
- Quali procedure di manutenzione sono richieste per un elettrodo a carbonio vetroso? Una guida passo-passo per prestazioni affidabili