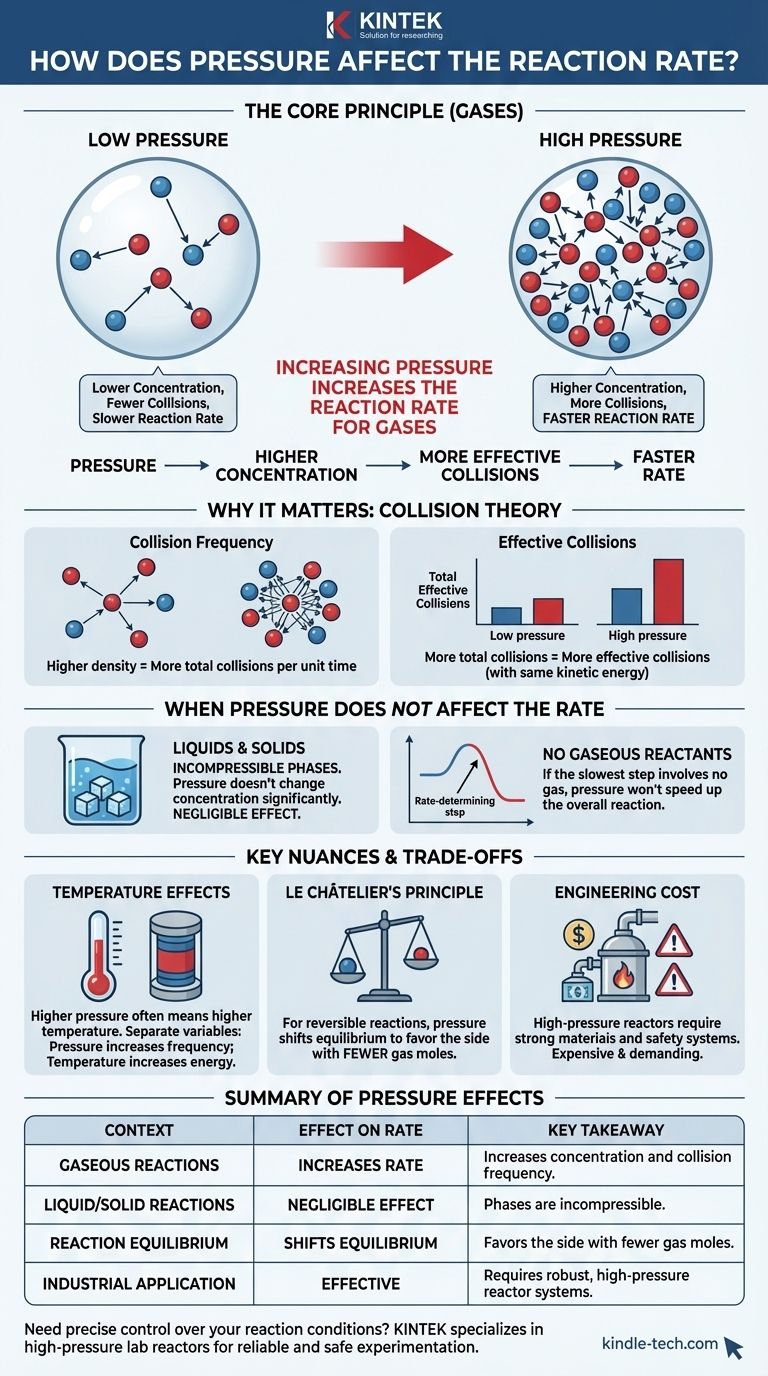
In sintesi, l'aumento della pressione di una reazione che coinvolge gas aumenta la velocità di reazione. Ciò avviene perché la pressione è una misura diretta della concentrazione per i gas. Comprimendo le molecole di gas in un volume più piccolo, si aumenta la probabilità che esse collidano e reagiscano tra loro.
Il principio fondamentale è che, per le reazioni gassose, la pressione agisce come una leva diretta sulla concentrazione. Una pressione più elevata costringe le molecole di gas ad avvicinarsi, aumentando la frequenza delle collisioni efficaci e accelerando così la reazione. Questo effetto è trascurabile per le reazioni in fase liquida o solida.

Il meccanismo fondamentale: perché la pressione è importante
Per comprendere veramente l'effetto della pressione, dobbiamo tornare ai primi principi di come avvengono le reazioni chimiche. Tutto ruota attorno al concetto di collisione tra particelle.
La pressione come misura della concentrazione
Per i gas, la pressione non è una forza astratta; è il risultato delle molecole di gas che collidono con le pareti del loro contenitore.
La legge dei gas ideali mostra una relazione diretta tra pressione (P) e numero di moli (n) in un dato volume (V) a temperatura costante (T). Più molecole nello stesso spazio significano più pressione. Pertanto, aumentare la pressione equivale funzionalmente ad aumentare la concentrazione.
Il ruolo della teoria delle collisioni
Le reazioni chimiche si verificano quando le particelle reagenti collidono con due condizioni chiave soddisfatte:
- Devono avere energia cinetica sufficiente per superare la barriera dell'energia di attivazione.
- Devono collidere con l'orientamento fisico corretto.
Una collisione che soddisfa entrambi i criteri è chiamata collisione efficace. La velocità di una reazione è determinata dalla frequenza di queste collisioni efficaci.
Più pressione = Più collisioni
Quando si aumenta la pressione di un sistema gassoso, si costringono lo stesso numero di molecole in un volume più piccolo.
Questa maggiore densità significa che la distanza media tra le molecole diminuisce. Di conseguenza, il numero totale di collisioni tra le molecole reagenti per unità di tempo aumenta in modo significativo.
L'impatto sulle collisioni "efficaci"
Sebbene l'aumento della pressione aumenti il numero totale di collisioni, non modifica l'energia cinetica delle singole molecole (supponendo che la temperatura rimanga costante).
Pertanto, la percentuale di collisioni che sono efficaci rimane la stessa. Tuttavia, poiché il numero totale di collisioni è aumentato, aumenta anche il numero assoluto di collisioni efficaci al secondo. Questo è ciò che spinge la velocità di reazione più in alto.
Quando la pressione non influisce sulla velocità
Il legame tra pressione e velocità di reazione è potente, ma non è universale. È fondamentale sapere quando non si applica.
Reazioni in fase liquida e solida
I liquidi e i solidi sono considerati fasi incomprimibili. L'applicazione di pressione esterna non modifica significativamente il loro volume o la spaziatura tra le loro particelle costituenti.
Poiché le variazioni di pressione non alterano la concentrazione dei reagenti nei liquidi e nei solidi, la pressione ha un effetto trascurabile sulle velocità delle reazioni che avvengono esclusivamente in queste fasi.
Reazioni senza reagenti gassosi
Se un meccanismo di reazione comporta più passaggi, la velocità complessiva è determinata dal passaggio più lento, noto come passaggio che determina la velocità.
Se questo passaggio che determina la velocità non coinvolge reagenti gassosi, le variazioni di pressione esterna non influenzeranno la velocità di reazione complessiva.
Comprendere i compromessi e le sfumature
Il controllo della pressione è una strategia industriale comune, ma comporta considerazioni importanti che vanno oltre i semplici cambiamenti di velocità.
Distinzione dagli effetti della temperatura
In pratica, la compressione di un gas ne aumenta la temperatura. Sia l'aumento della pressione che l'aumento della temperatura aumentano le velocità di reazione, ma per motivi diversi.
È fondamentale isolare le variabili. La pressione aumenta la frequenza delle collisioni, mentre la temperatura aumenta l'energia e la forza di tali collisioni, rendendo efficace una percentuale maggiore di esse.
Principio di Le Châtelier ed equilibrio
Per le reazioni reversibili che raggiungono uno stato di equilibrio, la pressione svolge un duplice ruolo. Secondo il Principio di Le Châtelier, l'aumento della pressione sposterà la posizione di equilibrio per favorire il lato della reazione con meno moli di gas.
Questo è un concetto separato dalla cinetica (velocità). La pressione aumenta la velocità sia della reazione diretta che di quella inversa, ma può spostare il bilancio finale di prodotti e reagenti.
Il costo ingegneristico dell'alta pressione
Costruire e mantenere reattori ad alta pressione è tecnologicamente impegnativo e costoso. I materiali devono essere sufficientemente resistenti per sopportare lo stress e sono necessari ampi sistemi di sicurezza per prevenire guasti catastrofici. Questo compromesso economico e di sicurezza è un fattore importante nella progettazione dei processi industriali.
Applicazione al tuo obiettivo
Il tuo approccio all'uso della pressione dipende interamente dal sistema chimico con cui stai lavorando e da ciò che stai cercando di ottenere.
- Se il tuo obiettivo principale è massimizzare la velocità di reazione per un processo gassoso: Aumentare la pressione è un metodo diretto ed efficace, a condizione che tu possa gestire le variazioni di temperatura e i costi ingegneristici associati.
- Se stai studiando l'equilibrio chimico: Ricorda che la pressione influisce sia sulle velocità di reazione sia sulla posizione finale dell'equilibrio, favorendo il lato con meno molecole di gas.
- Se la tua reazione coinvolge solo liquidi o solidi: La variazione della pressione esterna non è una strategia praticabile per controllare la velocità di reazione; concentrati invece su temperatura, concentrazione o catalizzatori.
Comprendendo il legame diretto della pressione con la concentrazione, ottieni una potente leva per controllare la cinetica delle reazioni gassose.
Tabella riassuntiva:
| Effetto della pressione sulla velocità di reazione | Concetto chiave |
|---|---|
| Reazioni gassose | Aumenta la velocità aumentando la concentrazione e la frequenza delle collisioni. |
| Reazioni liquido/solido | Effetto trascurabile; le fasi sono incomprimibili. |
| Equilibrio di reazione | Sposta l'equilibrio per favorire il lato con meno moli di gas. |
| Applicazione industriale | Efficace ma richiede sistemi di reattori robusti e ad alta pressione. |
Hai bisogno di un controllo preciso delle condizioni di reazione? KINTEK è specializzata in reattori da laboratorio ad alta pressione e attrezzature progettate per esperimenti affidabili e sicuri. Sia che tu stia ottimizzando la velocità di reazione di un gas o studiando l'equilibrio chimico, le nostre soluzioni offrono le prestazioni e la sicurezza di cui hai bisogno. Contatta i nostri esperti oggi stesso per trovare il sistema perfetto per le sfide uniche del tuo laboratorio.
Guida Visiva
Prodotti correlati
- Reattori personalizzabili ad alta pressione per applicazioni scientifiche e industriali avanzate
- Reattore Autoclave di Laboratorio ad Alta Pressione in Acciaio Inossidabile
- Mini reattore autoclave ad alta pressione in SS per uso di laboratorio
- Fornace a tubo sottovuoto ad alta pressione da laboratorio
- Reattore Autoclave da Laboratorio ad Alta Pressione per Sintesi Idrotermale
Domande frequenti
- Quale ruolo svolge un'autoclave nella simulazione delle condizioni PWR? Validazione avanzata dei materiali per la sicurezza nucleare
- Come dimostra il suo valore un reattore ad alta pressione nell'invecchiamento accelerato? Prevedere la durata del catalizzatore in modo rapido
- Quali ruoli svolgono gli autoclavi nella sintesi delle zeoliti MFI? Padronanza della crescita cristallina idrotermale
- Perché i recipienti di reazione sigillati da laboratorio sono necessari nella sintesi idrotermale delle zeoliti? Garantire purezza e resa
- Qual è la funzione di un reattore idrotermale a temperatura costante? Attivazione della cenere volante del carbone



















