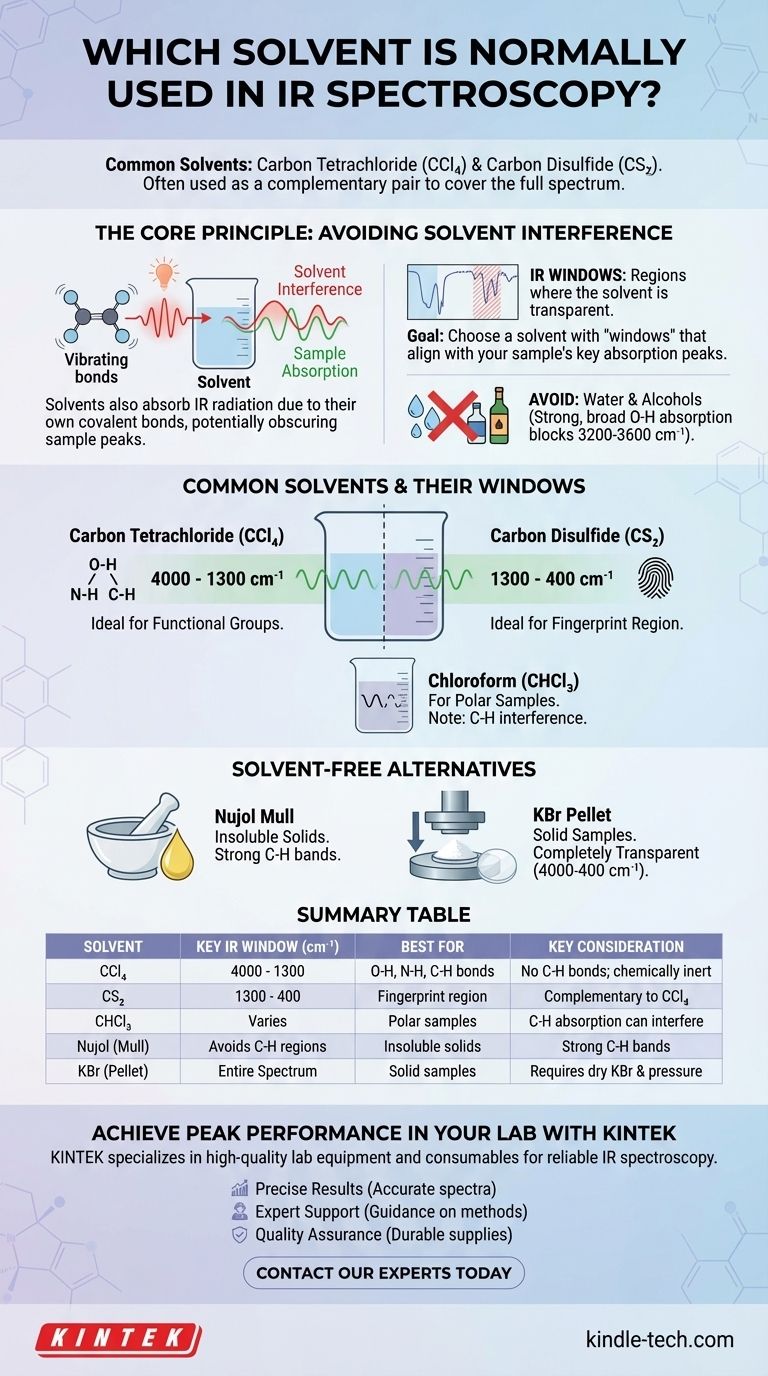
I solventi più comuni per la spettroscopia IR sono il tetracloruro di carbonio (CCl₄) e il disolfuro di carbonio (CS₂). Poiché nessun singolo solvente è trasparente sull'intero spettro infrarosso, questi due sono spesso usati come coppia complementare per analizzare diverse regioni. La scelta del solvente è fondamentale, poiché l'obiettivo è dissolvere il campione senza che le vibrazioni molecolari del solvente stesso oscurino le bande di assorbimento del campione.
Il principio fondamentale della selezione del solvente nella spettroscopia IR è trovare un mezzo che dissolva il tuo composto ma che sia esso stesso "invisibile" nella regione spettrale che ti interessa. Poiché non esiste un solvente perfetto, il processo implica la scelta strategica di un solvente con "finestre IR" trasparenti note che si allineano con i picchi di assorbimento chiave del tuo campione.

Il Principio Fondamentale: Evitare l'Interferenza del Solvente
La spettroscopia infrarossa funziona misurando le vibrazioni dei legami molecolari. La sfida è che i legami covalenti all'interno di qualsiasi molecola di solvente assorbiranno anche la radiazione IR, creando i propri picchi spettrali che possono interferire o mascherare completamente i picchi del tuo campione.
Perché i Solventi Assorbono la Radiazione IR
Proprio come il tuo campione, le molecole di solvente sono costituite da atomi collegati da legami covalenti. Questi legami (come C-H, C-Cl, C=S) si allungano e si piegano a frequenze specifiche quando assorbono la luce infrarossa. Questo assorbimento è la fonte di interferenza.
Il Concetto di "Finestre IR"
Nessun solvente è trasparente nell'intero intervallo del medio IR (4000 – 400 cm⁻¹). Tuttavia, ogni solvente ha regioni in cui assorbe solo debolmente o per niente. Queste aree sono chiamate "finestre IR."
L'obiettivo è scegliere un solvente le cui finestre corrispondano alle regioni di assorbimento dei gruppi funzionali che si desidera studiare nel campione.
Il Problema dell'Acqua e degli Alcoli
I solventi con gruppi -OH, come l'acqua e l'etanolo, non vengono quasi mai usati per l'IR. Il legame O-H produce una banda di assorbimento intensamente forte e ampia che oscura completamente una vasta e importante regione dello spettro (all'incirca 3200-3600 cm⁻¹), rendendo impossibile vedere qualsiasi picco del campione in quell'area.
Solventi Comuni e le Loro Finestre
Per ottenere uno spettro completo, i chimici spesso eseguono due scansioni dello stesso campione: una in un solvente che è trasparente nella regione ad alta frequenza e un'altra in un solvente che è trasparente nella regione a bassa frequenza "fingerprint".
Tetracloruro di Carbonio (CCl₄)
Questa è la scelta standard per la regione da 4000 cm⁻¹ a 1300 cm⁻¹. Poiché non ha legami C-H, è trasparente dove si verificano le vibrazioni di stiramento C-H, N-H e O-H, rendendolo ideale per analizzare questi gruppi funzionali critici.
Disolfuro di Carbonio (CS₂)
Questo è il solvente complementare al CCl₄. È in gran parte trasparente nella regione fingerprint da 1300 cm⁻¹ a 400 cm⁻¹. Ciò consente un'analisi dettagliata delle complesse vibrazioni che conferiscono a una molecola la sua identità spettrale unica.
Cloroformio (CHCl₃)
Il cloroformio è un solvente più polare e può essere una buona scelta se il campione non si dissolve in CCl₄ o CS₂. Tuttavia, il suo stesso legame C-H crea bande di assorbimento (intorno a 3000 cm⁻¹ e 1200 cm⁻¹) che possono interferire con l'analisi dei legami C-H nel campione.
Comprendere i Compromessi e le Alternative
La scelta di un solvente è solo un modo per preparare un campione. Se il tuo composto è insolubile o se l'interferenza del solvente è inevitabile, esistono altre tecniche standard.
L'Inerzia Chimica è Non Negoziabile
Come notato nel materiale di riferimento, il solvente non deve reagire con il tuo campione. L'uso di un solvente acido per un campione basico, ad esempio, risulterebbe in una coppia ionica, e si analizzerebbe lo spettro di una specie chimica completamente diversa da quella prevista.
Il Nujol Mull: Un'Alternativa Senza Solvente
Quando un campione è insolubile in tutti i solventi IR adatti, un Nujol mull è la tecnica preferita. Il campione solido viene macinato in una polvere fine e mescolato con una goccia di Nujol (un olio minerale) per formare una pasta.
Questa pasta viene poi pressata tra due piastre di sale per l'analisi. Il Nujol stesso è costituito da idrocarburi a catena lunga, quindi mostrerà forti bande di assorbimento C-H, ma è trasparente altrove, consentendo l'analisi della maggior parte degli altri gruppi funzionali.
La Pastiglia di KBr
Un altro metodo comune senza solvente è la pastiglia di KBr. Il campione solido viene mescolato con bromuro di potassio (KBr) puro e secco in polvere e pressato ad alta pressione per formare un piccolo disco trasparente. Il KBr è legato ionicamente e non assorbe la radiazione IR, rendendolo un mezzo completamente trasparente per l'analisi.
Fare la Scelta Giusta per la Tua Analisi
La scelta del metodo di preparazione del campione dipende interamente dalle proprietà fisiche del tuo campione e dalle informazioni specifiche di cui hai bisogno dallo spettro.
- Se il tuo obiettivo principale sono i legami O-H, N-H o C-H (4000-1300 cm⁻¹): Usa il tetracloruro di carbonio (CCl₄) per la sua eccellente trasparenza in questa regione.
- Se il tuo obiettivo principale è la regione fingerprint (1300-400 cm⁻¹): Usa il disolfuro di carbonio (CS₂) per ottenere una visione chiara delle complesse vibrazioni uniche della tua molecola.
- Se il tuo campione è insolubile in solventi non polari: Considera un'opzione più polare come il cloroformio, oppure evita completamente i solventi liquidi e prepara una pastiglia di KBr o un Nujol mull.
In definitiva, una preparazione efficace del campione consiste nell'assicurarsi che lo spettro registrato sia quello del tuo composto, non un artefatto del mezzo scelto.
Tabella Riepilogativa:
| Solvente | Finestra IR Chiave (cm⁻¹) | Ideale Per | Considerazione Chiave |
|---|---|---|---|
| Tetracloruro di Carbonio (CCl₄) | 4000 - 1300 | Legami O-H, N-H, C-H | Nessun legame C-H; chimicamente inerte |
| Disolfuro di Carbonio (CS₂) | 1300 - 400 | Regione fingerprint | Complementare al CCl₄ |
| Cloroformio (CHCl₃) | Varia (es. lacune intorno a 3000 cm⁻¹) | Campioni polari | L'assorbimento C-H può interferire |
| Nujol (Mull) | Evita le regioni C-H | Solidi insolubili | Forti bande C-H dal Nujol |
| KBr (Pastiglia) | Intero spettro (4000-400) | Campioni solidi | Richiede KBr secco e alta pressione |
Raggiungi le Massime Prestazioni nel Tuo Laboratorio
La navigazione nella selezione dei solventi è solo un passo verso un'analisi precisa dei materiali. KINTEK è specializzata nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità di cui hai bisogno per una spettroscopia IR affidabile e oltre.
Lasciaci aiutarti a migliorare le capacità del tuo laboratorio:
- Risultati Precisi: Assicurati che la preparazione del tuo campione porti a spettri accurati e privi di interferenze.
- Supporto Esperto: Ottieni indicazioni sugli strumenti e metodi giusti per la tua specifica applicazione.
- Garanzia di Qualità: Affidati ai nostri materiali di consumo durevoli e affidabili per prestazioni costanti.
Pronto a ottimizzare i tuoi processi analitici? Contatta i nostri esperti oggi per discutere come KINTEK può supportare le esigenze uniche del tuo laboratorio nella spettroscopia e nell'analisi dei materiali.
Guida Visiva
Prodotti correlati
- Crogiolo di evaporazione per materia organica
- Biossido di iridio IrO2 per elettrolisi dell'acqua
- Reattore Autoclave da Laboratorio ad Alta Pressione per Sintesi Idrotermale
- Reattori personalizzabili ad alta pressione per applicazioni scientifiche e industriali avanzate
- Elettrodi di Riferimento Calomel Argento Cloruro Solfato di Mercurio per Uso di Laboratorio
Domande frequenti
- Qual è il tipo più economico di processo di produzione additiva? Inizia la stampa 3D con un budget limitato con FDM
- Quali sono le problematiche chiave nella sintesi dei nanomateriali? Superare le sfide del controllo di dimensioni, forma e purezza
- Quali precauzioni devono essere prese durante la spettroscopia FTIR? Garantire risultati accurati e affidabili
- Come viene raffreddato un evaporatore a fascio elettronico durante la deposizione? Gestione termica essenziale per processi stabili
- Quali sono gli usi del metodo di sinterizzazione? Una guida alla fabbricazione di componenti ad alte prestazioni
- Qual è il principio dell'effetto di spegnimento (quenching)? Sfruttare le interazioni molecolari per controllare la fluorescenza
- Qual è il più grande svantaggio della biomassa come fonte di energia? I costi nascosti della bassa densità energetica
- Qual è un'alternativa a un evaporatore rotante sottovuoto? Trova la giusta tecnologia di evaporazione per il tuo laboratorio





