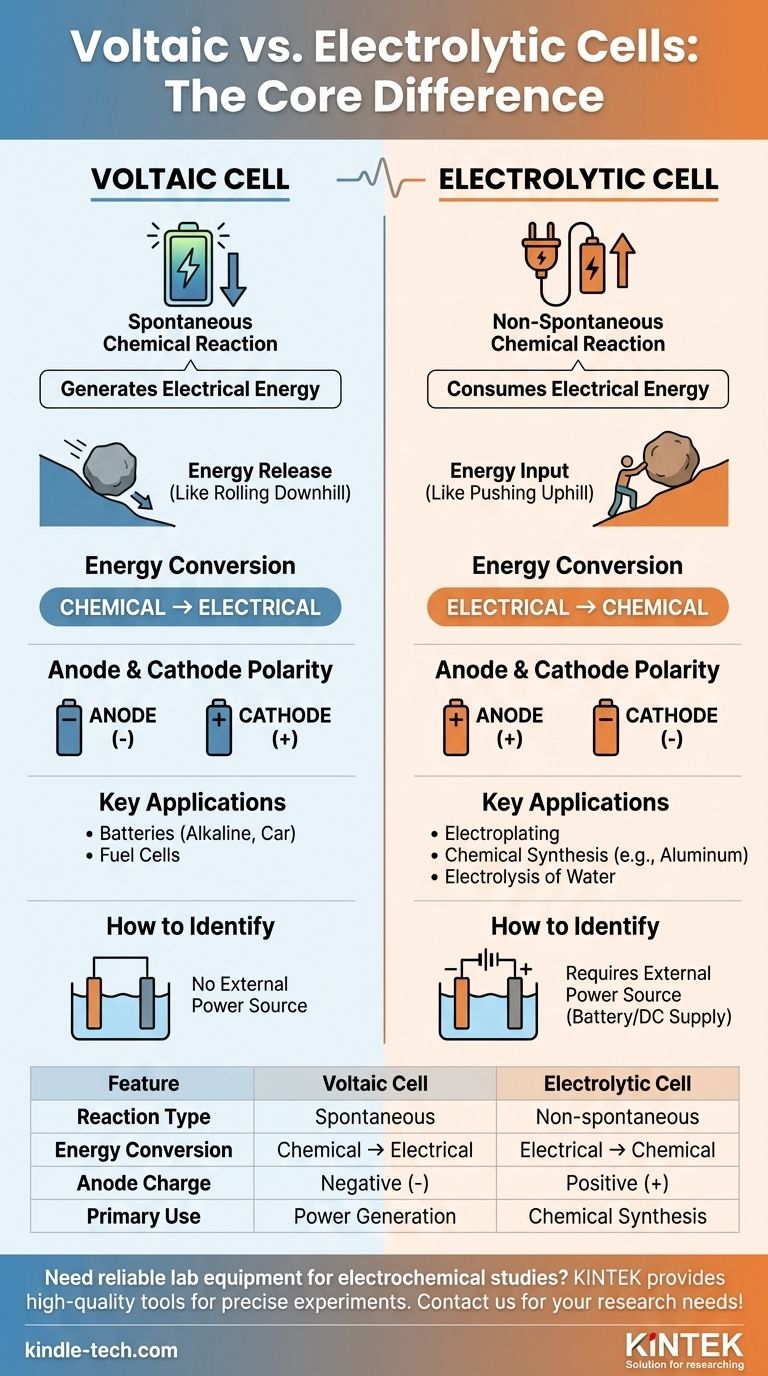
La differenza principale tra una cella voltaica e una cella elettrolitica risiede nel loro scopo fondamentale e nella natura delle reazioni chimiche coinvolte. Una cella voltaica, come una comune batteria, utilizza una reazione chimica spontanea per generare energia elettrica. Al contrario, una cella elettrolitica utilizza energia elettrica esterna per guidare una reazione chimica che non avverrebbe da sola.
In fondo, la distinzione riguarda il flusso di energia. Una cella voltaica è una fonte di energia che rilascia energia da una reazione chimica spontanea. Una cella elettrolitica è un consumatore di energia che forza una reazione chimica non spontanea a verificarsi.

Il Principio Fondamentale: Spontaneità
Il concetto più importante che separa queste due celle è se la reazione chimica è spontanea o non spontanea. Questo determina l'intera funzione e struttura della cella.
Celle Voltaiche: Rilascio Spontaneo di Energia
In una cella voltaica (chiamata anche cella galvanica), la reazione redox è spontanea. I reagenti hanno un'energia potenziale chimica più alta rispetto ai prodotti.
Questa tendenza naturale a reagire rilascia energia, che viene sfruttata come corrente elettrica. Pensate a un masso che rotola giù per una collina: accade senza alcuna spinta esterna.
Il potenziale di cella standard (E°cella) per una cella voltaica è sempre positivo, indicando una reazione spontanea.
Celle Elettrolitiche: Cambiamento Chimico Forzato
In una cella elettrolitica, la reazione redox è non spontanea. I prodotti si trovano in uno stato energetico superiore rispetto ai reagenti.
Per far avvenire questa reazione, deve essere applicata una fonte di alimentazione esterna (come una batteria o un alimentatore CC). Questo è come spingere il masso in salita: richiede un costante apporto di energia.
Il potenziale di cella standard (E°cella) per la reazione in una cella elettrolitica è negativo, confermando che non procederà senza aiuto esterno.
Principali Differenze Funzionali e Strutturali
La differenza di spontaneità porta a diverse distinzioni cruciali nel modo in cui queste celle sono costruite e come operano.
Conversione di Energia
Una cella voltaica esegue la conversione di energia chimica in energia elettrica. È un generatore di energia chimica.
Una cella elettrolitica fa esattamente l'opposto. Converte energia elettrica in energia chimica, utilizzando la potenza per creare nuove sostanze.
Polarità Anodo e Catodo
Questo è un frequente punto di confusione, ma è semplice se si ricordano le definizioni fondamentali. In entrambi i tipi di cella, l'ossidazione avviene sempre all'anodo e la riduzione avviene sempre al catodo.
Tuttavia, la carica di questi elettrodi è invertita:
- In una cella voltaica, l'anodo è la fonte di elettroni dalla reazione spontanea, rendendolo il terminale negativo (-). Il catodo è dove gli elettroni vengono consumati, rendendolo il terminale positivo (+).
- In una cella elettrolitica, la fonte di alimentazione esterna detta la carica. Spinge gli elettroni al catodo, rendendolo il terminale negativo (-). Tira gli elettroni via dall'anodo, rendendolo il terminale positivo (+).
Applicazioni Pratiche
Le applicazioni per ogni tipo di cella riflettono direttamente la loro funzione.
Le celle voltaiche sono utilizzate per alimentare dispositivi. Gli esempi includono le comuni batterie alcaline, le batterie per auto (durante la scarica) e le celle a combustibile.
Le celle elettrolitiche sono utilizzate per la sintesi e la purificazione. Le applicazioni comuni includono la galvanostegia dei metalli, la produzione di alluminio puro e l'elettrolisi dell'acqua per generare idrogeno e ossigeno gassoso.
Errori Comuni e Distinzioni Chiave
Per evitare errori comuni, concentrati sullo scopo della cella e sulla presenza di una fonte di alimentazione esterna.
Scopo: Potenza vs. Produzione
Il modo più semplice per distinguerli è dal loro obiettivo. La cella produce elettricità o usa elettricità per produrre una sostanza chimica? La prima è voltaica; la seconda è elettrolitica.
Il Ruolo del Ponte Salino
Le celle voltaiche sono spesso costituite da due semicelle separate collegate da un ponte salino. Questo componente è cruciale per mantenere la neutralità della carica mentre gli ioni fluiscono durante la reazione spontanea.
Le celle elettrolitiche sono tipicamente più semplici nella costruzione, spesso si svolgono in un unico contenitore dove l'elettrolita stesso consente il movimento degli ioni.
L'Alimentazione Esterna
L'indicatore visivo più chiaro in un diagramma è la presenza di una batteria o di un alimentatore. Se ne vedi uno collegato agli elettrodi, stai osservando una cella elettrolitica. La sua assenza implica una cella voltaica.
Fare la Scelta Giusta per il Tuo Obiettivo
Per identificare il tipo di cella o comprenderne la funzione, considera l'obiettivo primario del sistema.
- Se il tuo obiettivo principale è alimentare un dispositivo: Stai lavorando con una cella voltaica, che sfrutta una reazione chimica spontanea per produrre corrente.
- Se il tuo obiettivo principale è produrre una sostanza pura (come cloro gassoso o rame metallico): Stai usando una cella elettrolitica, che guida una reazione non spontanea con una fonte di alimentazione esterna.
- Se stai analizzando un diagramma con una batteria esterna: Questo indica una cella elettrolitica, poiché fornisce l'energia necessaria per forzare il cambiamento chimico.
Comprendere questa divisione fondamentale tra generazione spontanea e reazione forzata è la chiave per padroneggiare l'elettrochimica.
Tabella Riepilogativa:
| Caratteristica | Cella Voltaica | Cella Elettrolitica |
|---|---|---|
| Tipo di Reazione | Spontanea | Non spontanea (richiede alimentazione esterna) |
| Conversione di Energia | Chimica → Elettrica | Elettrica → Chimica |
| Carica dell'Anodo | Negativa (-) | Positiva (+) |
| Uso Principale | Generazione di energia (es. batterie) | Sintesi chimica (es. galvanostegia) |
Hai bisogno di attrezzature da laboratorio affidabili per i tuoi studi elettrochimici? KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità, fornendo gli strumenti precisi di cui hai bisogno per esperimenti che coinvolgono celle voltaiche ed elettrolitiche. Dagli elettrodi agli alimentatori, le nostre soluzioni aiutano a garantire risultati accurati e riproducibili nel tuo laboratorio. Contattaci oggi per trovare l'attrezzatura perfetta per le tue esigenze di ricerca!
Guida Visiva
Prodotti correlati
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrochimica Elettrolitica a Diffusione di Gas Cella di Reazione a Flusso Liquido
- Bagno d'acqua per cella elettrochimica elettrolitica multifunzionale a strato singolo e doppio
- Apparecchiatura per laboratori di batterie Tester completo per capacità e prestazioni delle batterie
Domande frequenti
- Qual è la funzione di una cella elettrolitica nell'arricchimento del trizio? Potenziamento del rilevamento per analisi a basso livello
- Come fa una cella elettrochimica a tre elettrodi a garantire l'accuratezza scientifica? Ottenere un'analisi precisa della corrosione
- Come viene utilizzata la frammentazione elettrochimica per aumentare la superficie dei metalli liquidi? Aumentare l'efficienza catalitica
- Come fa un sistema di cella elettrolitica a tre elettrodi a controllare il caricamento di nanosheet di MnO2? Raggiungere una precisione a livello micro
- Quali sono i tre componenti essenziali che costituiscono una cella elettrolitica? Elementi chiave della sintesi chimica
- Come fa un sistema di incisione elettrolitica potenziostatica a valutare la sensibilizzazione dell'AISI 316Ti? Conformità ASTM A262
- Quali sono i vantaggi tecnici dell'utilizzo di un contenitore in vetro da 1 litro a tre elettrodi? Ottimizzare la fedeltà dei dati
- Come fa un'apparecchiatura di laboratorio per l'anodizzazione elettrochimica a ottenere la crescita controllata di nanotubi di biossido di titanio?














