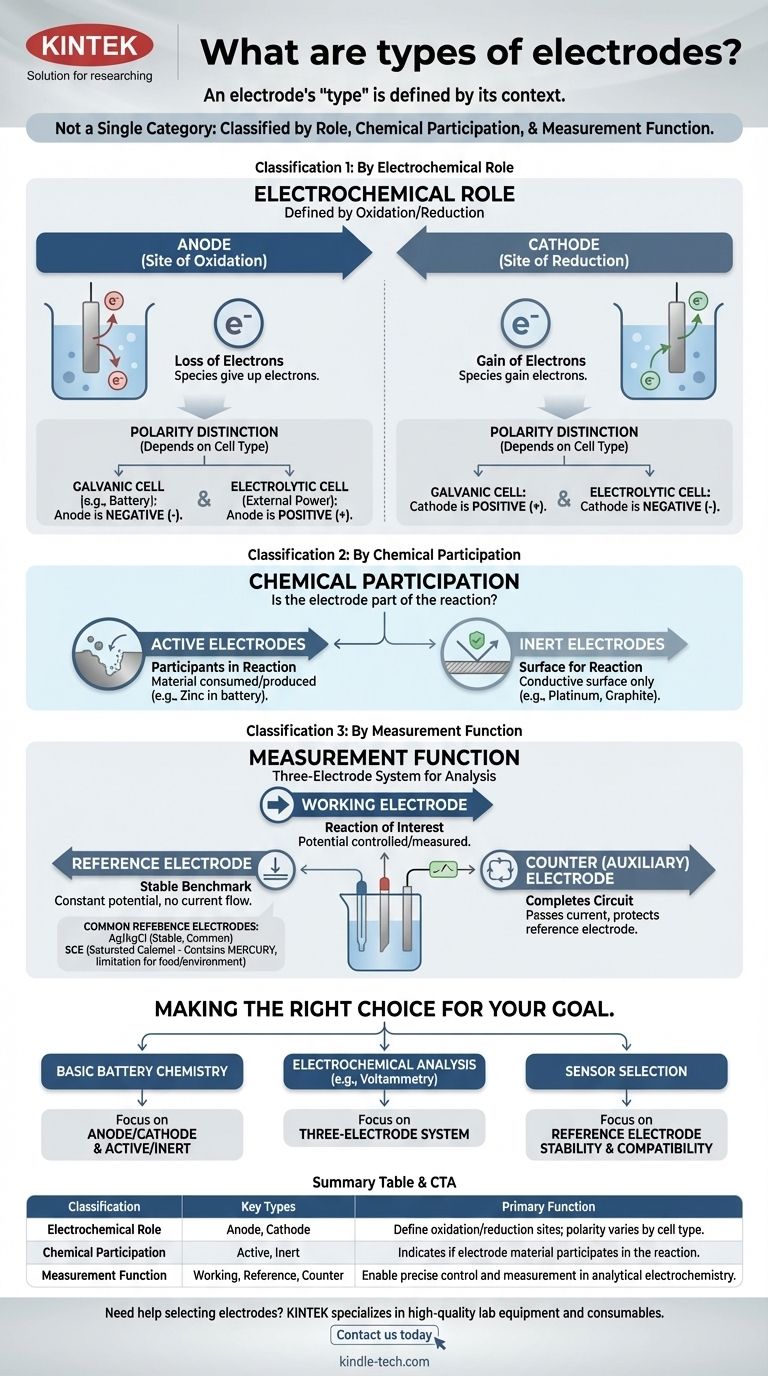
Il termine "elettrodo" non è una singola categoria. Al contrario, gli elettrodi sono classificati in diversi modi distinti in base al loro ruolo in una reazione, alla loro partecipazione chimica e alla loro funzione all'interno di un sistema di misurazione. Comprendere questi diversi sistemi di classificazione è la chiave per afferrare il loro scopo in qualsiasi cella elettrochimica.
L'intuizione più critica è che il "tipo" di un elettrodo è definito dal suo contesto. Lo stesso pezzo di metallo può essere un anodo o un catodo, attivo o inerte, a seconda interamente del sistema elettrochimico in cui lo si colloca.
Classificazione 1: Per Ruolo Elettrochimico
La classificazione più fondamentale definisce un elettrodo in base al suo ruolo nelle due metà di una reazione elettrochimica: ossidazione e riduzione.
L'Anodo: Il Sito di Ossidazione
L'anodo è, per definizione, l'elettrodo dove avviene l'ossidazione—la perdita di elettroni. Le specie all'anodo cedono i loro elettroni all'elettrodo.
Il Catodo: Il Sito di Riduzione
Il catodo è l'elettrodo dove avviene la riduzione—l'acquisizione di elettroni. Il catodo cede i suoi elettroni alle specie in soluzione.
La Distinzione Critica: Polarità Anodo/Catodo
Un punto comune di confusione è la carica (+ o -) dell'anodo e del catodo. Questa polarità dipende dal tipo di cella:
- In una cella galvanica (come una batteria), la reazione spontanea genera energia. L'anodo è il terminale negativo e il catodo è il terminale positivo.
- In una cella elettrolitica, una fonte di energia esterna guida una reazione non spontanea. L'anodo è il terminale positivo e il catodo è il terminale negativo.
Classificazione 2: Per Partecipazione Chimica
Questa classificazione descrive se il materiale dell'elettrodo stesso fa parte della reazione chimica.
Elettrodi Attivi: Partecipanti alla Reazione
Un elettrodo attivo è realizzato con un materiale che viene consumato o prodotto durante la reazione della cella. Ad esempio, in una batteria zinco-rame, l'anodo di zinco si dissolve, partecipando attivamente alla semireazione di ossidazione.
Elettrodi Inerti: Una Superficie per la Reazione
Un elettrodo inerte non partecipa alla reazione chimica. Serve solo come superficie conduttiva dove può avvenire l'ossidazione o la riduzione. Il platino e il carbonio (grafite) sono elettrodi inerti comuni utilizzati per facilitare reazioni che coinvolgono gas o ioni disciolti.
Classificazione 3: Per Funzione di Misurazione
Nell'elettrochimica analitica, un sistema a tre elettrodi è spesso utilizzato per misurazioni precise. Ciò dà origine a una classificazione funzionale.
L'Elettrodo di Lavoro
Questo è l'elettrodo dove avviene la reazione di interesse. Il suo potenziale è la variabile primaria controllata o misurata.
L'Elettrodo di Riferimento: Il Punto di Riferimento Stabile
Un elettrodo di riferimento fornisce un potenziale stabile e costante rispetto al quale viene misurato il potenziale dell'elettrodo di lavoro. Il suo potenziale non cambia indipendentemente dalla corrente che scorre o dalla composizione della soluzione in massa.
L'Elettrodo Ausiliario (o Contro-elettrodo)
Lo scopo esclusivo di questo elettrodo è quello di completare il circuito elettrico. Trasmette tutta la corrente necessaria all'elettrodo di lavoro, assicurando che una corrente trascurabile fluisca attraverso il sensibile elettrodo di riferimento, proteggendone così la stabilità.
Comprendere i Compromessi: Elettrodi di Riferimento Comuni
La scelta dell'elettrodo di riferimento è fondamentale per misurazioni accurate e dipende dall'ambiente chimico.
Ag/AgCl: Il Cavallo di Battaglia Comune
L'elettrodo Argento/Cloruro d'Argento (Ag/AgCl) è l'elettrodo di riferimento più comune. È stabile, economico e generalmente affidabile, il che lo rende una scelta predefinita per molte soluzioni acquose.
Elettrodo a Calomelano Saturato (ECS): L'Alternativa Classica
L'Elettrodo a Calomelano Saturato (ECS) è uno standard più vecchio e altamente stabile. Viene spesso utilizzato in situazioni in cui la soluzione campione è incompatibile con ioni argento o cloruro, che potrebbero interferire con l'elettrodo Ag/AgCl.
Il Problema del Mercurio: Una Limitazione Chiave
Il principale svantaggio dell'ECS è che contiene mercurio. Ciò lo rende inadatto per applicazioni che coinvolgono alimenti, bevande o test ambientali dove la contaminazione da mercurio è una preoccupazione significativa.
Fare la Scelta Giusta per il Tuo Obiettivo
La tua applicazione determina quale classificazione è più importante.
- Se il tuo obiettivo principale è comprendere la chimica di base delle batterie: Padroneggia i concetti di anodo/catodo ed elettrodi attivi/inerti.
- Se il tuo obiettivo principale è eseguire analisi elettrochimiche (come la voltammetria): Il sistema a tre elettrodi (di lavoro, di riferimento, ausiliario) è il quadro essenziale.
- Se il tuo obiettivo principale è selezionare un sensore per un ambiente specifico: La tua principale preoccupazione sarà la compatibilità chimica e la stabilità del tuo elettrodo di riferimento, come la scelta tra Ag/AgCl e un'alternativa.
Comprendere queste classificazioni sovrapposte ti permette di controllare e interpretare il comportamento di qualsiasi sistema elettrochimico.

Tabella Riepilogativa:
| Classificazione | Tipi Chiave | Funzione Primaria |
|---|---|---|
| Ruolo Elettrochimico | Anodo, Catodo | Definiscono i siti di ossidazione/riduzione; la polarità varia in base al tipo di cella (galvanica/elettrolitica) |
| Partecipazione Chimica | Attivo, Inerte | Indica se il materiale dell'elettrodo partecipa alla reazione o agisce solo come superficie |
| Funzione di Misurazione | Di Lavoro, Di Riferimento, Ausiliario | Consentono un controllo e una misurazione precisi nell'elettrochimica analitica |
Hai bisogno di aiuto per selezionare gli elettrodi giusti per le applicazioni elettrochimiche del tuo laboratorio? In KINTEK, siamo specializzati nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità, su misura per le tue esigenze di ricerca. Che tu stia lavorando allo sviluppo di batterie, alla progettazione di sensori o a misurazioni analitiche, la nostra esperienza ti garantisce di ottenere gli elettrodi ottimali per precisione e prestazioni. Contattaci oggi per discutere le tue esigenze e migliorare i tuoi flussi di lavoro elettrochimici!
Guida Visiva
Prodotti correlati
- Elettrodo a disco rotante in platino per applicazioni elettrochimiche
- Elettrodo a disco d'oro
- Elettrodo di riferimento al solfato di rame per uso di laboratorio
- Elettrodo Ausiliario in Platino per Uso di Laboratorio
- Elettrodo a foglio di platino per applicazioni di laboratorio e industriali
Domande frequenti
- Qual è la differenza tra RDE e RRDE? Sblocca l'analisi avanzata delle reazioni elettrochimiche
- Cos'è il metodo dell'elettrodo a disco ad anello rotante? Sblocca l'analisi delle reazioni in tempo reale
- Quali sono le caratteristiche prestazionali degli elettrodi in filo/barra di platino? Stabilità impareggiabile per il tuo laboratorio
- Come si deve pulire un elettrodo a filo/barra di platino prima dell'uso? Una guida per dati elettrochimici affidabili
- Quali sono le specifiche dell'elettrodo funzionale Platino-Titanio? Massimizzare le prestazioni elettrochimiche



















