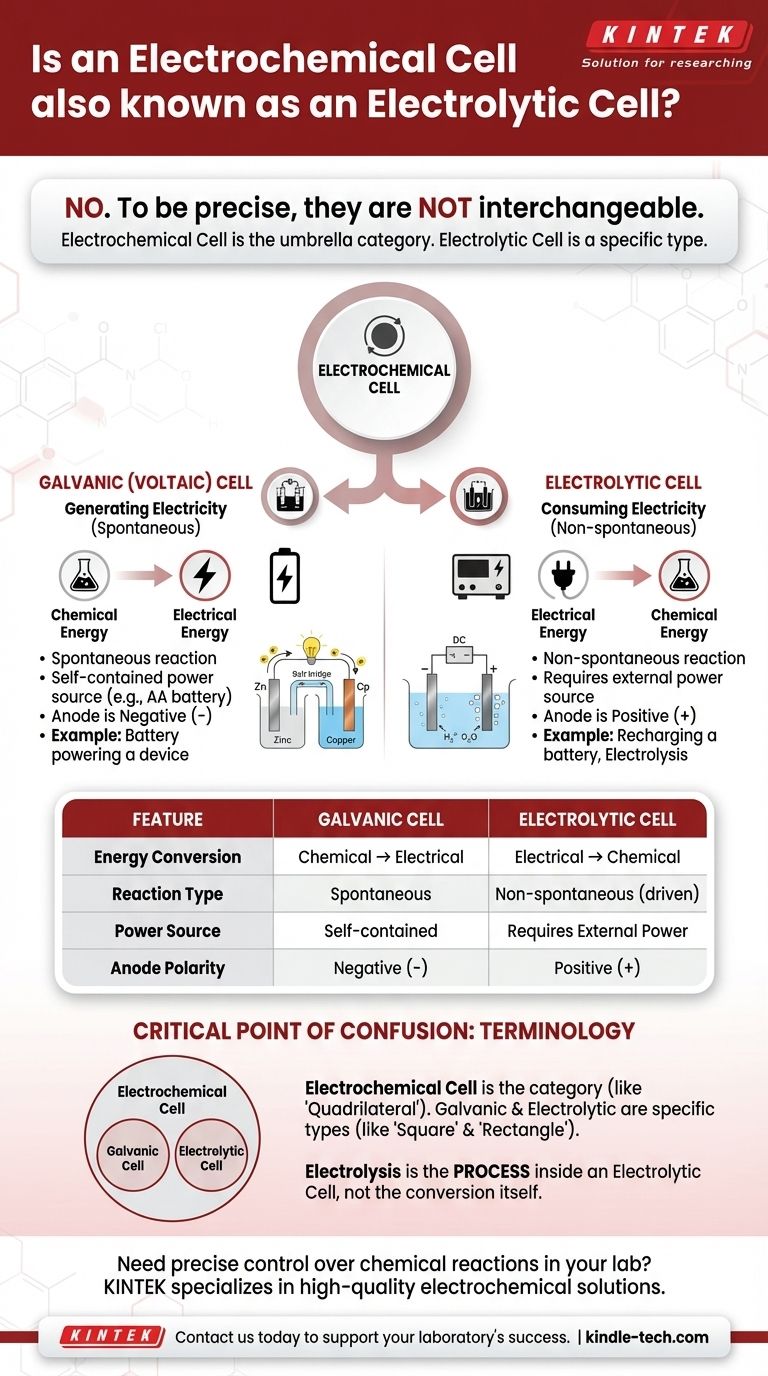
Per essere precisi, no. Una cella elettrolitica è un tipo specifico di cella elettrochimica, ma i due termini non sono intercambiabili. "Cella elettrochimica" è la categoria ampia e generica per qualsiasi dispositivo che converte energia chimica in energia elettrica o viceversa. Le celle elettrolitiche sono il tipo che utilizza specificamente energia elettrica per causare una reazione chimica.
La distinzione fondamentale si riduce alla direzione della conversione energetica. Una cella galvanica (o voltaica) rilascia spontaneamente energia da una reazione chimica per creare elettricità. Una cella elettrolitica consuma elettricità da una fonte esterna per forzare una reazione chimica a verificarsi.

La Distinzione Fondamentale: Flusso di Energia
Lo scopo di una cella elettrochimica ne determina la classificazione. La domanda principale da porsi è se la cella stia producendo energia o consumandola.
Celle Galvaniche (Voltaiche): Generazione di Elettricità
Una cella galvanica, conosciuta anche come cella voltaica, sfrutta una reazione chimica spontanea.
I reagenti all'interno della cella hanno una tendenza naturale a reagire, rilasciando energia nel processo. Questa energia viene catturata come corrente elettrica.
Pensa a una comune batteria AA in un telecomando. È una cella galvanica, che converte la sua energia chimica interna nell'energia elettrica necessaria per alimentare il telecomando.
Celle Elettrolitiche: Consumo di Elettricità
Una cella elettrolitica utilizza una fonte esterna di energia elettrica (come un alimentatore) per guidare una reazione chimica non spontanea.
Senza questa alimentazione esterna, la reazione chimica non avverrebbe da sola. L'elettricità forza la reazione a procedere contro la sua tendenza naturale.
Un esempio comune è l'elettrolisi, come la scissione dell'acqua in idrogeno e ossigeno gassosi. Un altro è la ricarica di una batteria agli ioni di litio; si usa l'elettricità per invertire la reazione di scarica e ripristinare il suo potenziale chimico.
Identificatori Chiave per Ogni Tipo di Cella
Oltre alla direzione del flusso di energia, alcune caratteristiche tecniche aiutano a differenziare i due tipi di celle.
Il Ruolo di una Fonte di Alimentazione Esterna
Questo è l'indicatore più semplice. Se un dispositivo è autonomo e agisce come fonte di alimentazione, è una cella galvanica.
Se il dispositivo richiede di essere collegato a una fonte di alimentazione esterna per funzionare, è una cella elettrolitica.
Polarità di Anodo e Catodo
Mentre le definizioni di anodo (dove avviene l'ossidazione) e catodo (dove avviene la riduzione) rimangono costanti, la loro carica elettrica (polarità) si inverte tra i due tipi di celle.
In una cella galvanica, l'anodo è il terminale negativo (-) e il catodo è il terminale positivo (+).
In una cella elettrolitica, la fonte di alimentazione esterna inverte questa situazione. L'anodo diventa il terminale positivo (+) e il catodo diventa il terminale negativo (-).
Il Punto Critico di Confusione: Terminologia
La principale fonte di confusione deriva dalla natura sovrapposta ma distinta dei termini. Non riuscire a differenziarli porta a incomprensioni fondamentali.
"Cella Elettrochimica" è il Termine Generico
Pensa a "cella elettrochimica" come alla categoria generale, come "quadrilatero".
Le celle galvaniche e le celle elettrolitiche sono i tipi specifici all'interno di quella categoria, proprio come "quadrato" e "rettangolo" sono tipi specifici di quadrilateri. Una cella elettrolitica è sempre una cella elettrochimica, ma non tutte le celle elettrochimiche sono elettrolitiche.
L'Uso Improprio di "Elettrolisi"
L'elettrolisi è il processo di utilizzo dell'elettricità per guidare una reazione chimica. Questo processo avviene all'interno di una cella elettrolitica.
Alcune definizioni affermano erroneamente che l'elettrolisi è la conversione di energia chimica in energia elettrica. Questo è l'opposto della verità. L'elettrolisi riguarda fondamentalmente l'uso dell'elettricità per creare un cambiamento chimico.
Fare la Giusta Distinzione per il Tuo Obiettivo
Per applicare correttamente questa conoscenza, identifica semplicemente la funzione primaria del dispositivo che stai analizzando.
- Se il tuo focus è su un dispositivo che alimenta qualcosa (un telecomando, un telefono, un orologio): Hai a che fare con una cella galvanica (voltaica), che converte l'energia chimica immagazzinata in elettricità.
- Se il tuo focus è su un processo che utilizza l'elettricità per creare una sostanza (ricaricare una batteria, placcare metalli, produrre gas cloro): Hai a che fare con una cella elettrolitica, che utilizza energia elettrica per forzare un cambiamento chimico.
- Se stai descrivendo il campo generale o un dispositivo con doppie capacità (come una batteria ricaricabile): Il termine "cella elettrochimica" è la scelta corretta e più inclusiva.
Comprendere la direzione della conversione energetica è la chiave per padroneggiare questo concetto fondamentale in chimica e ingegneria.
Tabella Riassuntiva:
| Caratteristica | Cella Galvanica (Voltaica) | Cella Elettrolitica |
|---|---|---|
| Conversione Energetica | Chimica → Elettrica | Elettrica → Chimica |
| Tipo di Reazione | Spontanea | Non spontanea (indotta) |
| Fonte di Alimentazione | Autonoma (es. batteria) | Richiede alimentazione esterna |
| Polarità dell'Anodo | Terminale negativo (-) | Terminale positivo (+) |
| Esempio Comune | Batteria AA in un telecomando | Ricarica di una batteria agli ioni di litio |
Hai bisogno di un controllo preciso sulle reazioni chimiche nel tuo laboratorio? Comprendere il giusto tipo di cella elettrochimica è fondamentale per la tua ricerca e i tuoi processi. In KINTEK, siamo specializzati nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità, su misura per le tue specifiche esigenze elettrochimiche. Che tu stia lavorando con celle galvaniche per la generazione di energia o celle elettrolitiche per la sintesi, le nostre soluzioni garantiscono precisione e affidabilità. Contattaci oggi per discutere come possiamo supportare il successo del tuo laboratorio!
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrolitica in PTFE Cella Elettrochimica Resistente alla Corrosione Sigillata e Non Sigillata
Domande frequenti
- Quali tipi di materiali vengono lucidati fondamentalmente mediante lucidatura elettrolitica? Una guida ai metalli e alle leghe
- Come è costruito il corpo della cella elettrolitica? Una guida ai materiali e ai componenti
- Qual è la funzionalità principale di una cella elettrochimica a tre elettrodi? Test di corrosione di precisione per rivestimenti
- Perché le celle elettrochimiche devono avere un condensatore e una guarnizione ad acqua per studi sulla lega 22 a 90°C? Garantire l'integrità dei dati
- Come assottigliare la finestra di radiazione di una cella in situ migliora l'imaging? Aumenta la chiarezza per la ricerca elettrochimica
- Qual è la funzione di una cella elettrolitica a tre camere di tipo H? Sbloccare complesse reazioni elettrochimiche a più fasi
- Quali ambienti operativi e opzioni di sigillatura sono disponibili per la cella spettroelettrochimica a strato sottile?
- Come fa un sistema di cella elettrolitica a tre elettrodi a garantire l'accuratezza? Ottimizzare i test di corrosione per i compositi di allumina



















