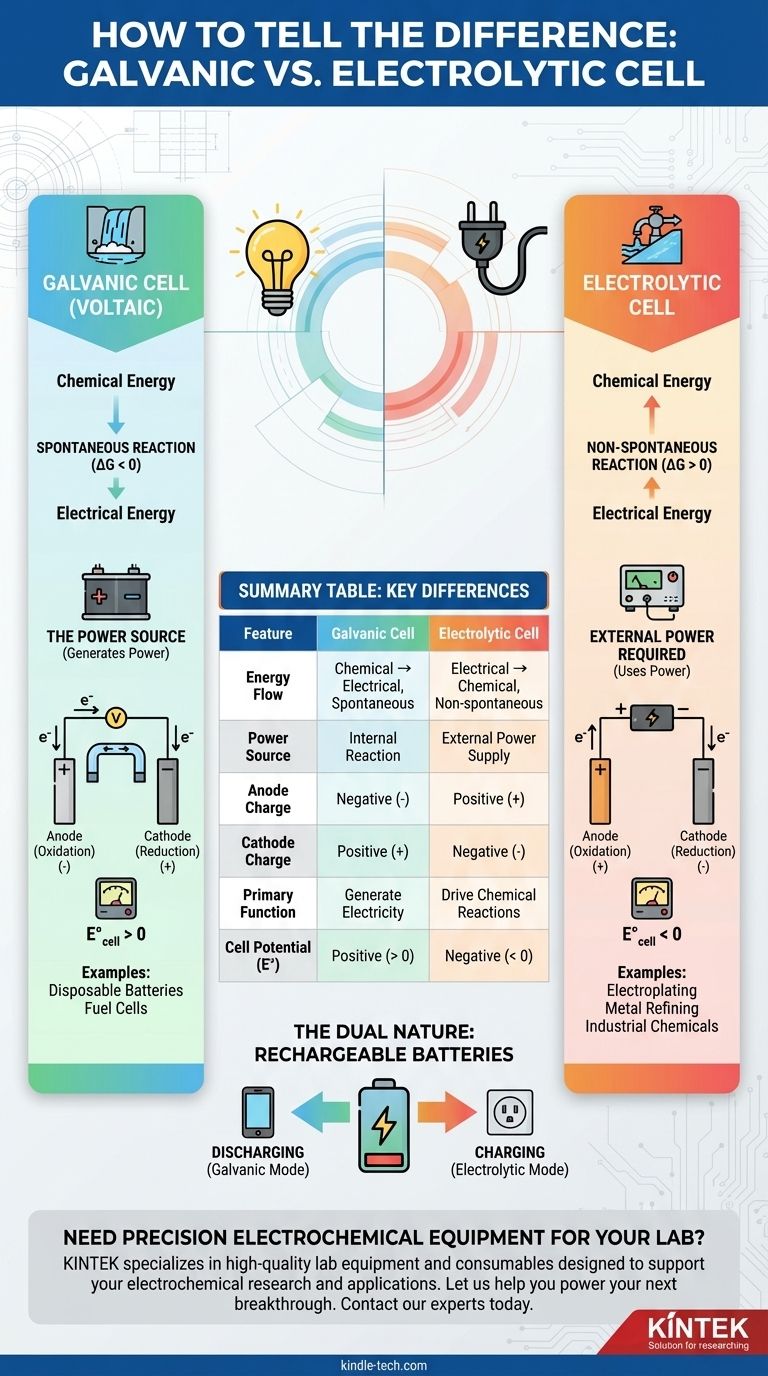
La differenza fondamentale tra una cella galvanica e una cella elettrolitica risiede nel flusso di energia. Una cella galvanica, nota anche come cella voltaica, utilizza una reazione chimica spontanea per generare energia elettrica. Al contrario, una cella elettrolitica utilizza energia elettrica esterna per forzare una reazione chimica non spontanea.
Pensala in questo modo: una cella galvanica è come una cascata che genera energia mentre scorre naturalmente verso il basso. Una cella elettrolitica è come una pompa che usa energia esterna per spingere l'acqua in salita contro la gravità.

Il Principio Fondamentale: Spontaneità e Conversione di Energia
Il comportamento di qualsiasi cella elettrochimica è dettato dal fatto che la sua reazione interna proceda da sola o richieda un intervento esterno.
Celle Galvaniche: Rilascio di Energia Chimica
Una cella galvanica è definita da una reazione redox spontanea. Ciò significa che la reazione vuole avvenire da sola, rilasciando energia nel processo.
Questo processo converte l'energia chimica immagazzinata direttamente in energia elettrica. La cella stessa è la fonte di energia.
Termodinamicamente, ciò corrisponde a un'energia libera di Gibbs negativa (ΔG < 0) e a un potenziale di cella positivo (E°_cella > 0).
Celle Elettrolitiche: Immissione di Energia Elettrica
Una cella elettrolitica comporta una reazione non spontanea. Senza una spinta esterna, questa reazione non avverrebbe.
Richiede una fonte di alimentazione esterna, come una batteria o un alimentatore CC, per far avanzare la reazione. Questo processo converte l'energia elettrica in energia chimica.
Ciò corrisponde a un'energia libera di Gibbs positiva (ΔG > 0) e a un potenziale di cella negativo (E°_cella < 0). La tensione esterna deve essere maggiore di questo potenziale negativo per forzare la reazione.
Come Identificare Ciascuna Cella: Indicatori Chiave
Oltre alla direzione del flusso di energia, è possibile distinguere tra le due celle osservando la polarità degli elettrodi e il circuito complessivo.
La Fonte di Energia
Questo è l'indicatore più diretto. Se la cella elettrochimica è la batteria che alimenta un dispositivo, è una cella galvanica.
Se la cella è collegata a una batteria esterna o a un alimentatore, è una cella elettrolitica. La fonte esterna fornisce l'energia per guidare il processo.
Polarità degli Elettrodi (Un Comune Punto di Confusione)
Le definizioni di anodo e catodo sono costanti per entrambi i tipi di celle:
- Anodo: L'elettrodo dove avviene l'ossidazione.
- Catodo: L'elettrodo dove avviene la riduzione.
Tuttavia, la loro carica positiva/negativa (polarità) si inverte:
In una cella galvanica, la reazione spontanea all'anodo rilascia elettroni, rendendolo il terminale negativo (-). Il catodo, che consuma elettroni, è il terminale positivo (+).
In una cella elettrolitica, la fonte di alimentazione esterna detta la polarità. Essa allontana gli elettroni dall'anodo, rendendolo il terminale positivo (+), e spinge gli elettroni al catodo, rendendolo il terminale negativo (-).
Applicazioni Comuni e Insidie
Lo scopo della cella è il suo differenziatore più pratico. Una crea energia, mentre l'altra usa energia per creare una sostanza o un cambiamento.
Lo Scopo di una Cella Galvanica
L'unica funzione di una cella galvanica è agire come fonte di energia elettrica.
Esempi comuni includono batterie usa e getta (AA, AAA), celle a combustibile e la funzione primaria di una batteria per auto quando avvia il motore.
Lo Scopo di una Cella Elettrolitica
L'obiettivo di una cella elettrolitica è di guidare una trasformazione chimica utile che altrimenti non avverrebbe.
Le applicazioni tipiche includono la galvanizzazione di un sottile strato di metallo su una superficie, la raffinazione di metalli come rame e alluminio e la produzione di prodotti chimici industriali come il cloro gassoso.
La Doppia Natura delle Batterie Ricaricabili
Una batteria ricaricabile è l'esempio perfetto di entrambi i tipi di celle in un unico dispositivo.
- Quando si scarica (alimentando il telefono): Agisce come una cella galvanica, con una reazione spontanea che genera elettricità.
- Quando si carica (collegata alla presa): Agisce come una cella elettrolitica, con energia esterna che forza la reazione inversa non spontanea per immagazzinare energia.
Fare la Giusta Distinzione per il Tuo Obiettivo
Per determinare rapidamente con quale cella hai a che fare, concentrati sul flusso di energia e sull'obiettivo generale del sistema.
- Se il tuo obiettivo principale è generare energia: Hai a che fare con una cella galvanica, dove una reazione spontanea rilascia energia.
- Se il tuo obiettivo principale è creare una sostanza o invertire una reazione: Stai usando una cella elettrolitica, che richiede una fonte di alimentazione esterna per guidare un processo non spontaneo.
- Se stai analizzando i segni degli elettrodi: Ricorda che in una cella galvanica l'anodo è negativo, mentre in una cella elettrolitica è positivo, perché la fonte di energia è interna o esterna.
In definitiva, capire se l'energia è un prodotto o un requisito è la chiave per distinguere tra queste due fondamentali celle elettrochimiche.
Tabella Riassuntiva:
| Caratteristica | Cella Galvanica | Cella Elettrolitica |
|---|---|---|
| Flusso di Energia | Chimica → Elettrica (Spontanea) | Elettrica → Chimica (Non spontanea) |
| Fonte di Energia | Reazione Interna | Alimentazione Esterna |
| Carica dell'Anodo | Negativa (-) | Positiva (+) |
| Carica del Catodo | Positiva (+) | Negativa (-) |
| Funzione Primaria | Generare Elettricità | Guidare Reazioni Chimiche (es. galvanizzazione) |
| Potenziale di Cella (E°) | Positivo (> 0) | Negativo (< 0) |
Hai Bisogno di Attrezzature Elettrochimiche di Precisione per il Tuo Laboratorio?
Comprendere le sfumature delle celle galvaniche ed elettrolitiche è cruciale per il lavoro di laboratorio avanzato. Che tu stia sviluppando nuove tecnologie per batterie, eseguendo galvanizzazione o conducendo analisi dei materiali, avere l'attrezzatura giusta è essenziale.
KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità progettati per supportare la tua ricerca e le tue applicazioni elettrochimiche. Forniamo soluzioni affidabili che garantiscono risultati accurati e migliorano l'efficienza del tuo laboratorio.
Lasciaci aiutarti a potenziare la tua prossima scoperta. Contatta oggi i nostri esperti per discutere le tue specifiche esigenze di laboratorio e scoprire come i nostri prodotti possono guidare il tuo successo.
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrochimica Elettrolitica a Diffusione di Gas Cella di Reazione a Flusso Liquido
- Apparecchiatura per laboratori di batterie Tester completo per capacità e prestazioni delle batterie
- Carta di carbonio idrofila TGPH060 per applicazioni di laboratorio per batterie
Domande frequenti
- Qual è la funzione di un reattore a circolazione interna a flusso ascendente in un MEC? Aumento dell'efficienza di degradazione del BTH
- Come facilitano le celle elettrolitiche la preparazione di leghe di metalli liquidi? Padroneggia il successo della lega elettrolitica
- Come si possono prevenire i cortocircuiti nell'allestimento della cella elettrolitica? Suggerimenti essenziali per la sicurezza e le prestazioni
- Quali sono i vantaggi di un dispositivo di lucidatura elettrolitica per campioni TEM di acciaio EK-181? Garantire l'integrità del campione di picco
- Quale precauzione dovrebbe essere presa riguardo al controllo della tensione durante un esperimento? Evita il fallimento del sistema con limiti di tensione adeguati
- Quali sono i vantaggi dell'utilizzo di una cella elettrochimica in PTFE nella ricerca sugli attinidi? Garantire dati precisi sulla corrosione
- Quali vantaggi offrono le celle divise e le membrane a scambio ionico nell'elettroestrazione dell'oro? Aumenta l'efficienza e la purezza
- Qual è la necessità di un sistema di test elettrochimico a temperatura costante? Garantire la precisione nella ricerca sui perovskiti




