In elettrochimica, gli elettrodi sono meglio compresi non come tre tipi distinti, ma attraverso due sistemi di classificazione principali. Il sistema più fondamentale definisce un elettrodo in base alla sua funzione: o un anodo, dove avviene l'ossidazione, o un catodo, dove avviene la riduzione. Un secondo sistema, altrettanto importante, li classifica in base alla loro composizione materiale e al ruolo nella reazione: o attivi (partecipanti alla reazione) o inerti (fornitori di una superficie per la reazione).
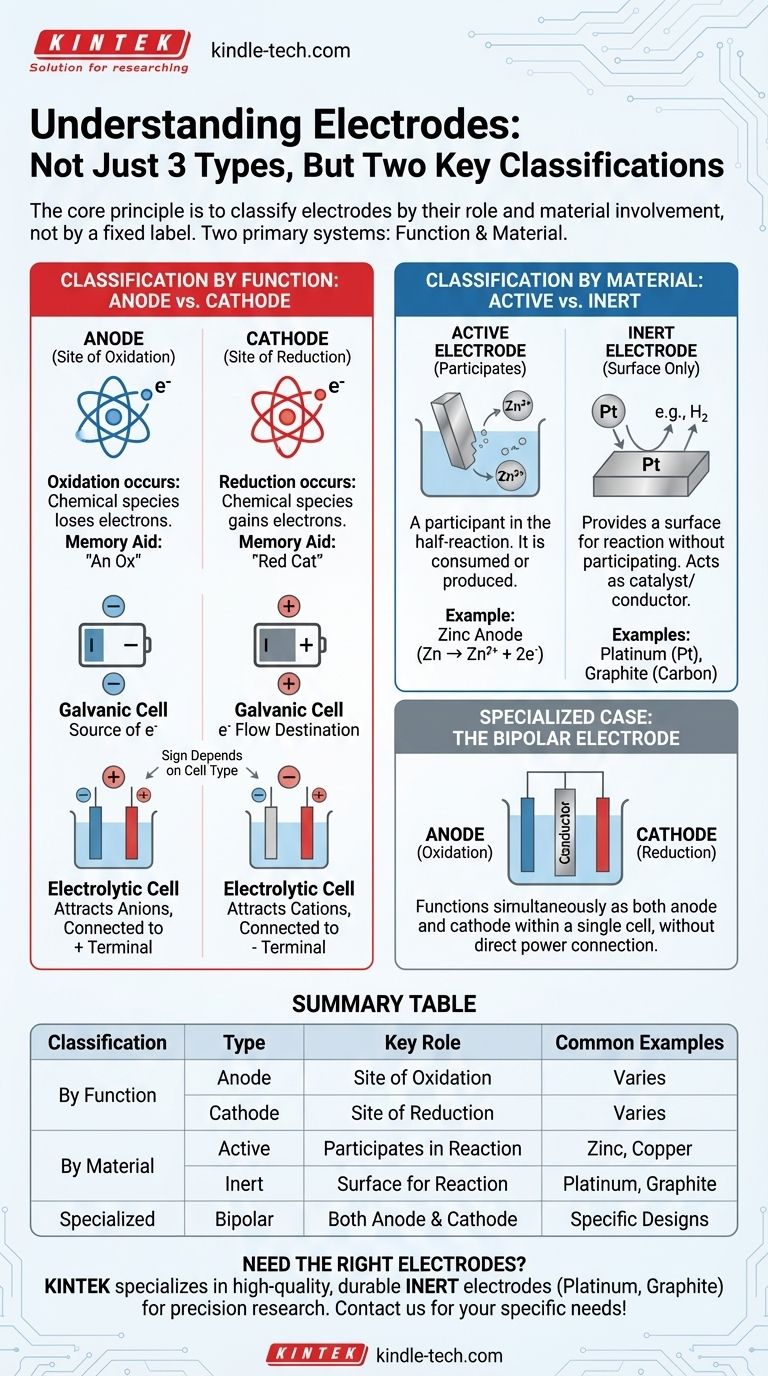
Il principio fondamentale è classificare gli elettrodi in base al loro ruolo, non in base a un'etichetta fissa. Le due classificazioni più critiche si basano sulla funzione (Anodo vs. Catodo) e sul coinvolgimento del materiale (Attivo vs. Inerte). Comprendere queste due coppie è la chiave per analizzare qualsiasi cella elettrochimica.

Classificazione per Funzione: Anodo vs. Catodo
Il modo più fondamentale per definire un elettrodo è in base al processo chimico che si verifica sulla sua superficie. Questo ruolo può cambiare a seconda del flusso di elettricità.
L'Anodo: Sede dell'Ossidazione
L'anodo è definito come l'elettrodo dove avviene l'ossidazione. Questo è un processo in cui una specie chimica perde elettroni.
Un semplice aiuto mnemonico è "An Ox" (Anodo è Ossidazione).
Il Catodo: Sede della Riduzione
Il catodo è l'elettrodo dove avviene la riduzione. Questo è un processo in cui una specie chimica acquista elettroni.
Un aiuto mnemonico corrispondente è "Red Cat" (Riduzione al Catodo).
La Distinzione Critica: Segno vs. Funzione
Un punto comune di confusione è se l'anodo e il catodo siano positivi o negativi. Ciò dipende interamente dal tipo di cella elettrochimica.
In una Cella Galvanica (come una Batteria)
Una cella galvanica produce elettricità da una reazione spontanea.
- L'Anodo è il terminale Negativo (-). È la fonte di elettroni dalla reazione di ossidazione.
- Il Catodo è il terminale Positivo (+). È dove fluiscono gli elettroni per causare la reazione di riduzione.
In una Cella Elettrolitica (come per la Placcatura)
Una cella elettrolitica utilizza elettricità esterna per guidare una reazione non spontanea.
- L'Anodo è il terminale Positivo (+). È collegato all'estremità positiva della sorgente di alimentazione, attirando gli anioni da ossidare.
- Il Catodo è il terminale Negativo (-). È collegato all'estremità negativa della sorgente di alimentazione, attirando i cationi da ridurre.
Classificazione per Materiale: Attivo vs. Inerte
La seconda classificazione principale descrive se il materiale dell'elettrodo stesso fa parte della reazione chimica.
Elettrodi Attivi
Un elettrodo attivo (o elettrodo reattivo) è un partecipante alla semireazione. È costituito da un materiale che viene ossidato o è il prodotto di una riduzione.
Ad esempio, in una batteria zinco-rame, l'anodo di zinco si dissolve fisicamente (si ossida) in ioni zinco (Zn → Zn²⁺ + 2e⁻). L'elettrodo stesso viene consumato.
Elettrodi Inerti
Un elettrodo inerte fornisce semplicemente una superficie affinché avvenga l'ossidazione o la riduzione senza partecipare alla reazione stessa. Agisce come catalizzatore e conduttore elettrico.
Gli elettrodi inerti comuni includono il platino (Pt) e la grafite (carbonio). Vengono utilizzati quando le specie ossidate o ridotte sono ioni o gas presenti nella soluzione.
Caso Speciale: L'Elettrodo Bipolare
Un elettrodo bipolare è un conduttore specializzato posto in una soluzione elettrolitica che non è collegato direttamente alla sorgente di alimentazione.
Funziona simultaneamente come anodo sul lato rivolto verso il catodo principale e come catodo sul lato rivolto verso l'anodo principale, consentendo una serie di reazioni all'interno di una singola cella.
Prendere la Decisione Giusta
La tua comprensione degli elettrodi dovrebbe guidare il modo in cui analizzi un sistema elettrochimico. Il "tipo" di elettrodo è definito dal suo contesto all'interno della cella.
- Se stai analizzando una batteria (cella galvanica): Identifica il sito di ossidazione come l'anodo negativo e il sito di riduzione come il catodo positivo.
- Se stai analizzando un processo elettrolitico (es. galvanostegia): Identifica l'elettrodo collegato al terminale positivo come anodo (ossidazione) e quello collegato al terminale negativo come catodo (riduzione).
- Quando progetti un esperimento: Devi decidere se hai bisogno di un elettrodo attivo che partecipi alla reazione o di un elettrodo inerte per facilitare semplicemente una reazione tra specie già presenti nella soluzione.
Concentrandoti sulla funzione e sul coinvolgimento del materiale, puoi descrivere e prevedere accuratamente il comportamento di qualsiasi elettrodo in qualsiasi sistema elettrochimico.
Tabella Riassuntiva:
| Classificazione | Tipo | Ruolo Chiave | Esempi Comuni |
|---|---|---|---|
| Per Funzione | Anodo | Sede dell'Ossidazione (perde elettroni) | Varia a seconda del tipo di cella |
| Catodo | Sede della Riduzione (acquista elettroni) | Varia a seconda del tipo di cella | |
| Per Materiale | Attivo | Partecipa alla reazione | Zinco, Rame |
| Inerte | Fornisce superficie per la reazione (non reattivo) | Platino, Grafite | |
| Specializzato | Bipolare | Funziona sia da anodo che da catodo | Utilizzato in specifici design di celle |
Hai bisogno degli elettrodi giusti per la tua applicazione elettrochimica? KINTEK è specializzata in attrezzature e materiali di consumo di laboratorio di alta qualità, inclusi elettrodi inerti durevoli realizzati in platino e grafite, progettati per precisione e affidabilità nel tuo laboratorio. Lascia che i nostri esperti ti aiutino a selezionare i componenti perfetti per la tua ricerca o processo. Contattaci oggi per discutere le tue esigenze specifiche!
Guida Visiva
Prodotti correlati
- Elettrodo a foglio d'oro per elettrochimica Elettrodo d'oro
- Elettrodo Elettrochimico a Disco Metallico
- Elettrodi di Riferimento Calomel Argento Cloruro Solfato di Mercurio per Uso di Laboratorio
- Elettrodo a disco rotante in platino per applicazioni elettrochimiche
- Elettrodo a disco d'oro
Domande frequenti
- Quali sono le caratteristiche prestazionali di un elettrodo a piastra d'oro? Stabilità ineguagliabile per dati affidabili
- Come si deve maneggiare un elettrodo a piastra d'oro durante un esperimento? Assicurare risultati accurati e riproducibili
- In quali scenari un elettrodo a placca d'oro dovrebbe essere dedicato a un singolo utente o scopo? Garantire la sicurezza del paziente e l'integrità dei dati
- Qual è il principio operativo di un elettrodo a disco d'oro in un sistema elettrochimico? Sblocca la precisione con un'interfaccia stabile
- Quali precauzioni dovrebbero essere adottate per prevenire danni meccanici a un elettrodo a piastra d'oro? Proteggi l'integrità dei tuoi dati



















