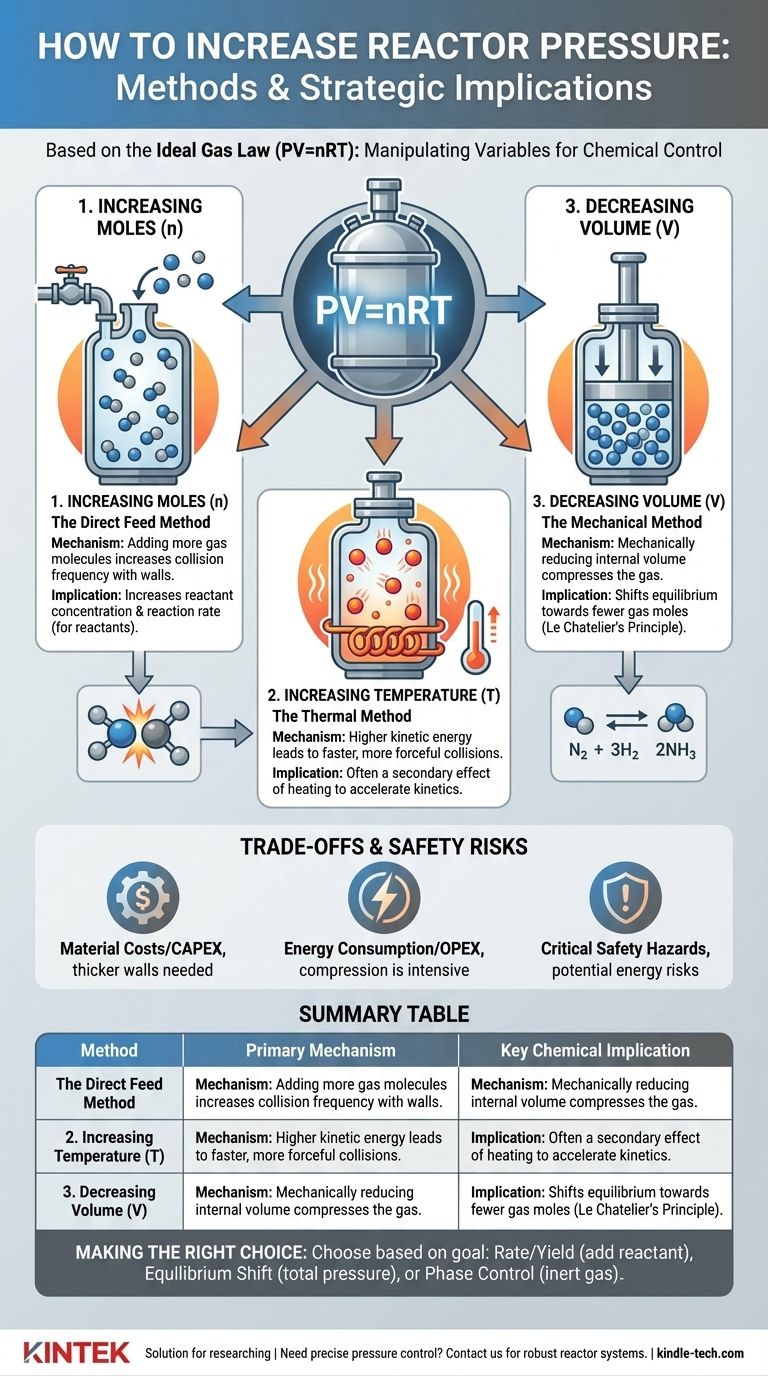
Nell'ingegneria chimica, l'aumento della pressione in un reattore si ottiene fondamentalmente manipolando le variabili della Legge dei Gas Ideali (PV=nRT). I metodi più comuni sono l'introduzione di più materiale (gas), l'aumento della temperatura del sistema o la riduzione meccanica del volume del reattore. Ogni metodo ha uno scopo distinto e comporta implicazioni significative per la cinetica, l'equilibrio e la sicurezza generale della reazione.
La sfida principale non è semplicemente come aumentare la pressione, ma perché lo si sta facendo. La scelta del metodo giusto dipende interamente dal fatto che il vostro obiettivo sia aumentare la concentrazione dei reagenti, spostare l'equilibrio chimico o controllare la fase dei materiali all'interno del reattore.

I principi fondamentali della generazione di pressione
In fondo, la pressione è il risultato delle collisioni delle molecole di gas con le pareti di un contenitore. Per aumentare questa pressione, è necessario rendere queste collisioni più frequenti o più energiche. La Legge dei Gas Ideali fornisce il quadro teorico di come ciò avviene.
Aumentare le moli (n): Il metodo di alimentazione diretta
Questo è l'approccio più semplice. Aggiungendo più molecole di gas in un volume fisso, si aumenta il numero di collisioni con le pareti del reattore, aumentando così la pressione.
Tuttavia, esiste una distinzione critica tra l'aggiunta di un reagente e l'aggiunta di un gas inerte. L'aggiunta di più di un reagente gassoso aumenta la sua pressione parziale, il che aumenta direttamente la sua concentrazione e può accelerare il tasso di reazione.
Al contrario, l'aggiunta di un gas inerte (come azoto o argon) aumenta la pressione totale del sistema ma non modifica le pressioni parziali dei reagenti. Questa tecnica è spesso utilizzata per controllare il comportamento di fase o per la gestione del calore, non per influenzare direttamente il tasso di reazione.
Aumentare la temperatura (T): Il metodo termico
Riscaldare un reattore sigillato aumenta l'energia cinetica delle molecole di gas al suo interno. Queste molecole energizzate si muovono più velocemente, portando a collisioni più frequenti e più energiche con le pareti del reattore, il che si manifesta come un aumento della pressione.
Questo metodo è spesso un effetto secondario dell'esecuzione di una reazione a una temperatura più elevata per aumentarne la velocità. L'aumento di pressione deve essere previsto e gestito come parte della progettazione del reattore.
Diminuzione del volume (V): Il metodo meccanico
Per alcuni tipi di reattori, la pressione può essere aumentata riducendo meccanicamente il volume interno. Si pensi a un pistone in un cilindro che comprime un gas.
Questo metodo è meno comune per i reattori continui su larga scala, ma è un principio primario in alcune configurazioni di laboratorio, processi batch e tipi specifici di compressori o motori.
Implicazioni chimiche di una pressione più elevata
L'aumento della pressione è uno strumento potente utilizzato per influenzare e controllare l'esito di una reazione chimica. Non è semplicemente un parametro fisico ma un fattore chiave del comportamento chimico.
Impatto sul tasso di reazione
Per la maggior parte delle reazioni in fase gassosa, l'aumento della pressione aggiungendo più reagenti forza le molecole ad avvicinarsi. Questa maggiore concentrazione porta a collisioni molecolari più frequenti, il che generalmente si traduce in un tasso di reazione più veloce.
Impatto sull'equilibrio
Questo è governato dal Principio di Le Chatelier. Se una reazione reversibile ha un numero diverso di moli di gas sul lato dei reagenti e dei prodotti, la modifica della pressione sposterà l'equilibrio.
L'aumento della pressione favorirà il lato della reazione con meno moli di gas. L'esempio classico è il processo Haber-Bosch per la sintesi dell'ammoniaca (N₂ + 3H₂ ⇌ 2NH₃), dove l'alta pressione viene utilizzata per spostare l'equilibrio verso il prodotto, l'ammoniaca.
Impatto sul comportamento di fase
La pressione è anche uno strumento critico per controllare lo stato fisico delle sostanze. L'alta pressione può impedire a un liquido di bollire, anche ad alte temperature, il che è essenziale per molte reazioni in fase liquida. Può anche essere utilizzata per liquefare i gas per la separazione o per facilitare reazioni che avvengono all'interfaccia tra un gas e un liquido.
Comprendere i compromessi e i rischi per la sicurezza
Sebbene una pressione più elevata possa offrire vantaggi significativi al processo, comporta costi e pericoli sostanziali che devono essere gestiti con attenzione.
Costi di materiale e costruzione
I reattori ad alta pressione richiedono pareti in acciaio più spesse, leghe più avanzate e guarnizioni e raccordi altamente specializzati per garantire il contenimento. Ciò aumenta drasticamente la spesa in conto capitale iniziale (CAPEX) di un progetto.
Consumo energetico
La compressione dei gas ad alte pressioni è un processo estremamente energivoro. Ciò si traduce direttamente in una maggiore spesa operativa (OPEX) e può avere un impatto significativo sulla redditività economica di un processo.
Pericoli critici per la sicurezza
La considerazione più importante è la sicurezza. Un sistema ad alta pressione immagazzina un'enorme quantità di energia potenziale. Una rottura o un guasto può portare a un rilascio catastrofico ed esplosivo.
Tutti i sistemi ad alta pressione devono essere dotati di più livelli di sicurezza, inclusi valvole di sfogo della pressione, dischi di rottura e rigorosi protocolli di ispezione e manutenzione per mitigare questi rischi.
Fare la scelta giusta per il tuo obiettivo
Il metodo corretto per aumentare la pressione è dettato dall'obiettivo specifico del processo chimico.
- Se il tuo obiettivo primario è aumentare il tasso di reazione e la resa: L'aggiunta diretta di più reagente gassoso è la strategia più efficace, in quanto aumenta le pressioni parziali che guidano la reazione.
- Se il tuo obiettivo primario è spostare un equilibrio chimico: L'aumento della pressione totale del sistema, sia tramite compressione che aggiungendo reagenti, è fondamentale per le reazioni in cui il lato del prodotto ha meno moli di gas.
- Se il tuo obiettivo primario è mantenere una fase liquida al di sopra del suo normale punto di ebollizione: L'aumento della pressione totale, spesso con un gas inerte, è la chiave per creare le condizioni di processo necessarie.
In definitiva, il controllo della pressione del reattore consiste nel manipolare strategicamente la termodinamica e la cinetica del sistema per raggiungere il risultato desiderato in modo sicuro ed efficiente.
Tabella riassuntiva:
| Metodo | Meccanismo primario | Implicazione chimica chiave |
|---|---|---|
| Aumento delle moli (n) | Aggiunta di più molecole di gas | Aumenta la concentrazione del reagente/il tasso di reazione |
| Aumento della temperatura (T) | Aumento dell'energia cinetica molecolare | Effetto secondario del riscaldamento per accelerare le reazioni |
| Diminuzione del volume (V) | Compressione meccanica del gas | Sposta l'equilibrio verso meno moli di gas |
Hai bisogno di un controllo preciso della pressione per i tuoi processi di laboratorio? KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità, inclusi robusti sistemi di reattori progettati per una gestione sicura ed efficiente della pressione. Le nostre soluzioni ti aiutano a raggiungere cinetiche di reazione, resa e sicurezza ottimali. Contatta KINTEK oggi per discutere come possiamo supportare le esigenze specifiche del tuo laboratorio.
Guida Visiva
Prodotti correlati
- Reattori da laboratorio personalizzabili ad alta temperatura e alta pressione per diverse applicazioni scientifiche
- Reattori personalizzabili ad alta pressione per applicazioni scientifiche e industriali avanzate
- Autoclave a vapore orizzontale per alta pressione da laboratorio per uso in laboratorio
- Reattore Autoclave da Laboratorio ad Alta Pressione per Sintesi Idrotermale
- Autoclave a Vapore ad Alta Pressione da Laboratorio Verticale per Reparto di Laboratorio
Domande frequenti
- Perché i reattori SCWG devono mantenere una specifica velocità di riscaldamento? Proteggi i tuoi recipienti ad alta pressione dallo stress termico
- Perché i reattori a tubo in lega ad alta resistenza sono fondamentali per l'HHIP? Garantire sicurezza e purezza in ambienti ad alta pressione
- Quali sono le caratteristiche tecniche dei reattori idrotermali rivestiti in PTFE (Teflon)? Confronto dei metodi di sintesi dell'α-ZrP
- Perché utilizzare reattori ad alta pressione per il pretrattamento dei rifiuti alimentari? Aumenta l'efficienza della produzione di idrogeno oggi stesso!
- Perché è necessaria un'autoclave idrotermale ad alta pressione per i nanofili di MnO2? Crescita di catalizzatori di precisione



















