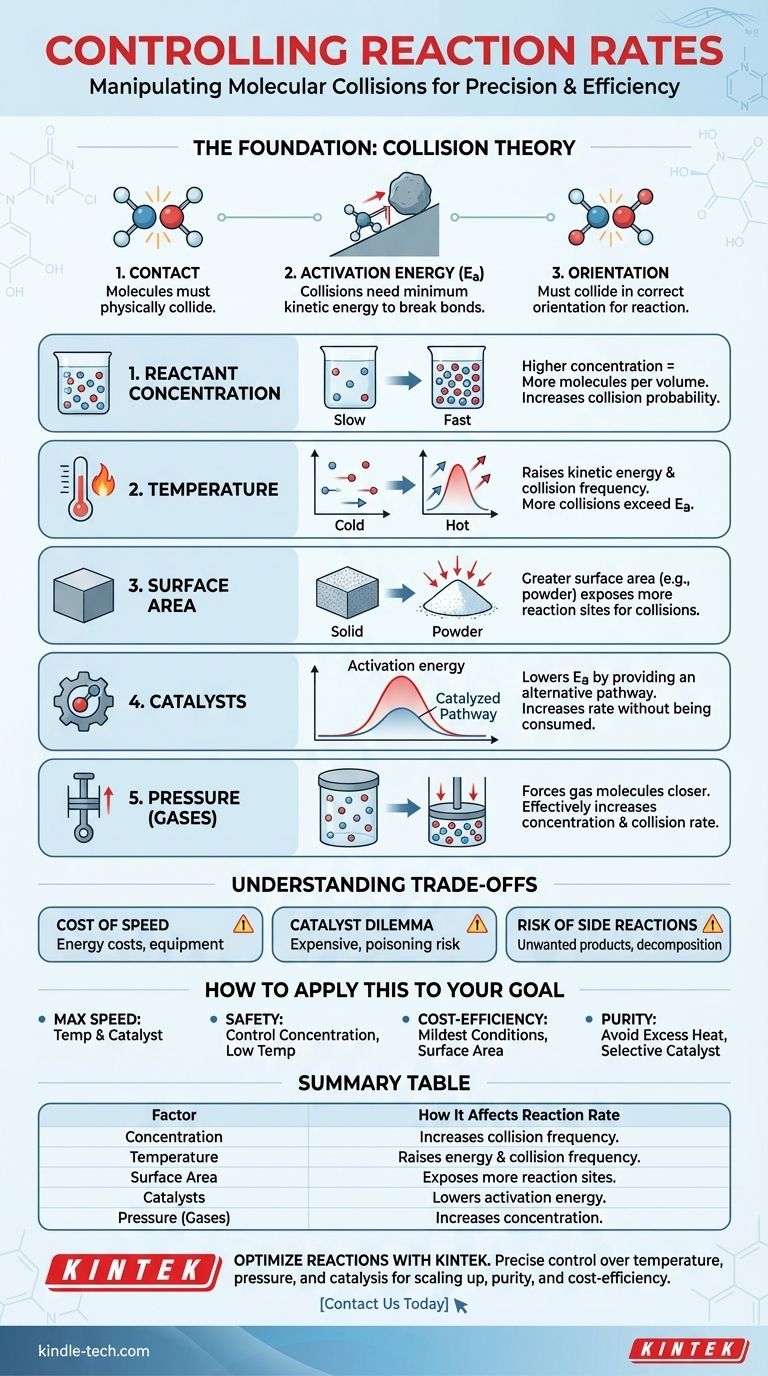
In sostanza, cinque fattori primari controllano la velocità di una reazione chimica: la concentrazione dei reagenti, la temperatura, lo stato fisico e la superficie dei reagenti, la presenza di un catalizzatore e, per i gas, la pressione. Ciascuno di questi fattori influenza la frequenza e l'energia delle collisioni molecolari, che è il motore fondamentale di ogni cambiamento chimico.
La velocità di qualsiasi reazione chimica è determinata dalla frequenza con cui le molecole reagenti collidono con l'orientamento corretto e con energia sufficiente per superare la barriera di energia di attivazione della reazione. Tutto ciò che controlla le velocità di reazione è semplicemente una leva per manipolare la frequenza e l'efficacia di queste collisioni.

Le Basi: La Teoria delle Collisioni
Per controllare una reazione, devi prima capire che le reazioni non sono eventi istantanei. Sono il risultato di interazioni fisiche tra molecole. Questo è spiegato dalla Teoria delle Collisioni.
La Necessità del Contatto
Affinché una reazione avvenga, le molecole reagenti devono collidere fisicamente tra loro. Se si trovano in contenitori separati, nessuna reazione può avvenire. La velocità della reazione è direttamente legata alla velocità di queste collisioni.
Il Requisito Energetico (Energia di Attivazione)
Una collisione da sola non è sufficiente. Le molecole che collidono devono possedere una certa quantità minima di energia cinetica, nota come energia di attivazione (Ea). Questa energia è necessaria per rompere i legami chimici esistenti in modo che se ne possano formare di nuovi.
Pensa all'energia di attivazione come a una collina su cui devi spingere un masso. Una leggera spinta (una collisione a bassa energia) non farà nulla. Devi fornire una spinta sufficiente (energia sufficiente) per portarlo in cima alla collina, dopodiché può rotolare dall'altra parte e rilasciare energia.
Il Fattore Orientamento
Infine, le molecole devono collidere con un orientamento specifico che permetta la rottura dei legami corretti e la formazione di nuovi. Una collisione casuale con l'angolo sbagliato, anche se sufficientemente energetica, non porterà a una reazione.
Le Cinque Leve per Controllare la Velocità di Reazione
Comprendere la teoria delle collisioni ti offre cinque leve distinte da azionare per accelerare o rallentare una reazione. Ognuna agisce influenzando la frequenza delle collisioni, l'energia delle collisioni o la barriera di energia di attivazione stessa.
1. Concentrazione dei Reagenti
Aumentare la concentrazione dei reagenti significa che ci sono più molecole impacchettate in un dato volume. Questo aumenta direttamente la probabilità che esse collidano, aumentando così la velocità di reazione.
2. Temperatura
Aumentare la temperatura ha un potente doppio effetto. In primo luogo, aumenta l'energia cinetica delle molecole, facendole muovere più velocemente e collidere più frequentemente. In secondo luogo, e più importante, aumenta l'energia di queste collisioni, il che significa che una percentuale maggiore di esse avrà energia sufficiente per superare la barriera di energia di attivazione.
3. Stato Fisico e Superficie
Questo è più rilevante per le reazioni che coinvolgono fasi diverse, come un solido che reagisce con un liquido (reazioni eterogenee). Un blocco solido ha una superficie limitata dove possono avvenire le collisioni. Macinare lo stesso blocco in una polvere fine aumenta drasticamente la sua superficie, esponendo più molecole e creando molti più siti per l'avvenimento delle reazioni.
4. Catalizzatori
Un catalizzatore aumenta la velocità di reazione senza essere consumato nel processo. Lo fa fornendo un percorso di reazione alternativo con un'energia di attivazione inferiore.
Tornando alla nostra analogia, un catalizzatore è come costruire un tunnel attraverso la collina. Non è più necessario spingere il masso fino in cima; puoi portarlo dall'altra parte con molto meno sforzo. Questo permette a più molecole di reagire con successo, anche a temperature più basse.
5. Pressione (per Reazioni Gassose)
Per le reazioni che coinvolgono gas, aumentare la pressione costringe le molecole di gas ad avvicinarsi. Questo è effettivamente lo stesso che aumentare la loro concentrazione, portando a collisioni più frequenti e a una velocità di reazione più elevata.
Comprendere i Compromessi
Manipolare le velocità di reazione non è senza conseguenze. Un consulente tecnico efficace deve considerare le implicazioni pratiche ed economiche di ogni scelta.
Il Costo della Velocità
Aumentare la temperatura e la pressione richiede energia, che costa denaro. Può anche richiedere reattori specializzati ad alta pressione che sono costosi da costruire e mantenere, introducendo considerazioni sulla sicurezza.
Il Dilemma del Catalizzatore
I catalizzatori possono essere molto efficaci ma sono spesso costosi (ad esempio, l'uso di metalli preziosi come il platino o il palladio). Possono anche essere molto specifici per una reazione e possono essere resi inattivi dalle impurità, un processo noto come "avvelenamento del catalizzatore".
Rischio di Reazioni Collaterali Indesiderate
Spingere una reazione troppo forte, specialmente con calore eccessivo, può portare a risultati indesiderabili. I reagenti o i prodotti potrebbero iniziare a decomporsi, o l'energia aumentata può abilitare reazioni collaterali indesiderate, riducendo la purezza e la resa del prodotto desiderato.
Come Applicare Questo al Tuo Obiettivo
La tua strategia per controllare una reazione dipende interamente da ciò che stai cercando di ottenere.
- Se il tuo obiettivo principale è la massima velocità: Le leve più potenti sono l'aumento della temperatura e l'uso di un catalizzatore efficace, poiché entrambi aumentano drasticamente il numero di collisioni riuscite ed energetiche.
- Se il tuo obiettivo principale è la sicurezza e il controllo: Gestire attentamente la concentrazione dei reagenti (ad esempio, aggiungendo un reagente lentamente a un altro) e utilizzare la temperatura efficace più bassa sono gli approcci migliori.
- Se il tuo obiettivo principale è l'efficienza dei costi: Ottimizza per le condizioni più miti possibili. Questo può comportare la ricerca di un catalizzatore economico o l'aumento della superficie per evitare gli alti costi energetici di calore e pressione estremi.
- Se il tuo obiettivo principale è la purezza del prodotto: Evita temperature eccessivamente alte che potrebbero causare decomposizione o reazioni collaterali, e assicurati che il tuo catalizzatore sia altamente selettivo per la reazione desiderata.
In definitiva, controllare una reazione chimica è l'arte di gestire con precisione le condizioni che governano le collisioni molecolari.
Tabella Riepilogativa:
| Fattore | Come Influisce sulla Velocità di Reazione |
|---|---|
| Concentrazione | Una maggiore concentrazione aumenta la frequenza delle collisioni tra le molecole reagenti. |
| Temperatura | Aumenta l'energia molecolare e la frequenza delle collisioni; più collisioni superano l'energia di attivazione. |
| Superficie | Una maggiore superficie (ad esempio, un solido in polvere) espone più siti di reazione per le collisioni. |
| Catalizzatori | Abbassa l'energia di attivazione fornendo un percorso di reazione alternativo. |
| Pressione (Gas) | Aumenta la concentrazione delle molecole di gas, portando a collisioni più frequenti. |
Ottimizza le tue reazioni chimiche con attrezzature di precisione di KINTEK. Che tu stia aumentando la produzione, garantendo la purezza del prodotto o massimizzando l'efficienza dei costi, le nostre attrezzature e i nostri materiali di consumo da laboratorio sono progettati per darti un controllo preciso sulle condizioni di reazione. Lascia che i nostri esperti ti aiutino a selezionare gli strumenti giusti per gestire temperatura, pressione e catalisi per le tue esigenze specifiche. Contattaci oggi per discutere come possiamo supportare il successo del tuo laboratorio!
Guida Visiva
Prodotti correlati
- Mini reattore autoclave ad alta pressione in SS per uso di laboratorio
- Reattore Autoclave di Laboratorio ad Alta Pressione in Acciaio Inossidabile
- Reattori personalizzabili ad alta pressione per applicazioni scientifiche e industriali avanzate
- Pressa Idraulica Riscaldata Automatica con Piastre Riscaldate per Pressa a Caldo da Laboratorio 25T 30T 50T
Domande frequenti
- Come i reattori ad alta temperatura e alta pressione migliorano il pretrattamento della biomassa? Aumenta la resa con l'esplosione di vapore
- Quali sono i vantaggi tecnici dell'utilizzo di reattori tubolari in acciaio inossidabile per l'acetalizzazione a flusso continuo?
- Come influisce l'uso di un'autoclave in acciaio inossidabile ad alta pressione sui catalizzatori BiVO4? Migliora le prestazioni di sintesi
- Come influiscono le velocità di agitazione nei reattori batch sull'idrolisi enzimatica? Ottimizzare il trasferimento di massa per la massima resa di glucosio
- Cos'è un reattore nella pirolisi? Il cuore della trasformazione dei materiali e del recupero energetico
- Qual è la funzione principale di un reattore ad alta pressione (autoclave)? Sintesi di precisione per catalizzatori avanzati
- Quali vantaggi fisico-chimici offrono i reattori a fluidi supercritici? Sblocca l'elaborazione potenziata della lignocellulosa
- Quali sono i vantaggi dell'utilizzo di un reattore in acciaio inossidabile 316L nell'idrolisi ELA? Ottimizza costi e prestazioni



