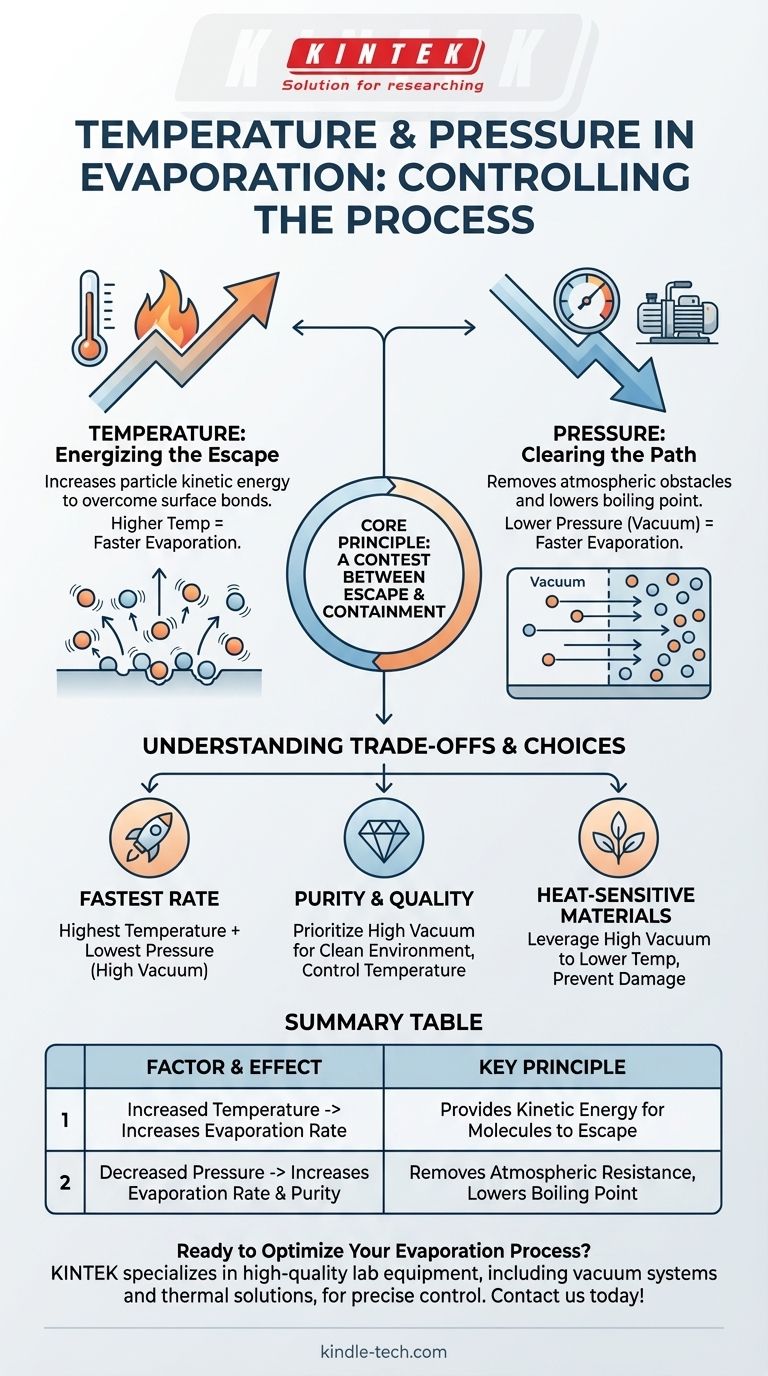
In qualsiasi processo di evaporazione, la temperatura e la pressione sono le due leve principali di controllo. L'aumento della temperatura fornisce alle molecole l'energia per sfuggire a una superficie, aumentando così il tasso di evaporazione. Al contrario, la diminuzione della pressione ambiente rimuove gli ostacoli atmosferici, il che aumenta significativamente anche il tasso di evaporazione.
Il principio fondamentale è una competizione tra fuga e contenimento. La temperatura fornisce alle molecole l'energia per sfuggire, mentre una pressione più bassa rimuove le forze esterne che le contengono, rendendo l'intero processo più veloce e più efficiente.

Il Ruolo della Temperatura: Dare Energia alla Fuga
La temperatura è il modo più diretto per influenzare la velocità con cui un materiale evapora. La relazione si basa sull'energia delle singole molecole o atomi.
L'Energia Cinetica è Fondamentale
La temperatura è fondamentalmente una misura dell'energia cinetica media (l'energia del movimento) delle particelle in una sostanza.
Quando si riscalda un materiale, si aumenta la velocità e la vibrazione delle sue particelle costituenti.
Superare i Legami Superficiali
Affinché una particella evapori, deve avere energia sufficiente per rompere i legami che la tengono attaccata alla superficie del materiale.
Temperature più elevate significano che una percentuale maggiore di particelle possiede questa necessaria "velocità di fuga", portando a un tasso di evaporazione complessivo più elevato.
Applicazione nella Deposizione di Materiali
In processi come la deposizione di film sottili, il riscaldamento del substrato bersaglio è fondamentale. Come accennato, il riscaldamento al di sopra dei 150 °C garantisce una buona adesione.
Questo perché gli atomi depositati arrivano con sufficiente energia termica per muoversi leggermente sulla superficie, stabilizzandosi in una struttura cristallina stabile, uniforme e ben legata.
Il Ruolo della Pressione: Liberare il Percorso
Mentre la temperatura fornisce la "spinta" per l'evaporazione, la pressione ambiente fornisce la "spinta contraria". Gestire questa pressione esterna è spesso altrettanto importante.
Resistenza Atmosferica
L'aria o il gas sopra una superficie esercitano pressione, creando una barriera di particelle che un atomo che evapora deve attraversare.
A pressione atmosferica standard, una particella che evapora entrerà in collisione con miliardi di molecole d'aria, rallentando il suo progresso e persino facendola ricadere sulla superficie.
Il Potere del Vuoto
Abbassare la pressione, o creare un vuoto, rimuove queste particelle atmosferiche. Ciò libera il percorso per gli atomi che evaporano.
In un vuoto spinto, un atomo può viaggiare in linea retta dalla sua sorgente alla sua destinazione (come un substrato) con una probabilità di collisione molto inferiore, aumentando drasticamente il tasso netto di evaporazione.
Abbassamento del Punto di Ebollizione
Un effetto critico della riduzione della pressione è che riduce il punto di ebollizione del materiale. L'ebollizione è semplicemente una rapida evaporazione che si verifica quando la pressione di vapore interna di un materiale eguaglia la pressione ambiente esterna.
Creando un vuoto, è possibile far evaporare o bollire i materiali a temperature molto più basse di quanto sarebbe possibile all'aria aperta. Ciò è essenziale per la lavorazione di materiali sensibili al calore.
Comprendere i Compromessi
Il controllo della temperatura e della pressione consente risultati precisi, ma richiede il bilanciamento di fattori in competizione.
Purezza rispetto al Tasso
In una camera a vuoto, l'obiettivo spesso non è solo un tasso elevato ma un'elevata purezza. Una pressione più bassa assicura che siano presenti meno molecole di gas contaminanti (come ossigeno o azoto) che possano interferire o rimanere incorporate nel film depositato finale.
Costi Energetici rispetto a Costi delle Apparecchiature
Il raggiungimento di temperature elevate richiede un significativo apporto energetico. Il raggiungimento di un vuoto spinto richiede sistemi di pompaggio costosi e complessi.
La scelta dipende spesso dalle proprietà del materiale. Potrebbe essere più efficiente utilizzare un vuoto moderato e una temperatura più alta per un materiale robusto, o un vuoto spinto e una temperatura più bassa per uno delicato.
Fare la Scelta Giusta per il Tuo Obiettivo
Le impostazioni ottimali per temperatura e pressione dipendono interamente da ciò che si sta cercando di ottenere con il processo di evaporazione.
- Se il tuo obiettivo principale è il tasso di evaporazione più rapido possibile: Utilizza la temperatura più alta che il materiale può tollerare combinata con la pressione più bassa possibile (vuoto più spinto).
- Se il tuo obiettivo principale è la purezza del materiale e la qualità del film: Dai la priorità al raggiungimento di un vuoto spinto per creare un ambiente pulito, quindi applica attentamente la temperatura per controllare il tasso di deposizione.
- Se il tuo obiettivo principale è la lavorazione di un materiale sensibile al calore: Sfrutta un vuoto spinto per abbassare significativamente la temperatura di evaporazione, prevenendo così danni termici alla sostanza.
In definitiva, padroneggiare l'evaporazione significa capire come utilizzare la temperatura e la pressione in concerto per raggiungere i tuoi obiettivi materiali specifici.
Tabella Riassuntiva:
| Fattore | Effetto sull'Evaporazione | Principio Chiave |
|---|---|---|
| Aumento della Temperatura | Aumenta il tasso di evaporazione | Fornisce energia cinetica alle molecole per sfuggire alla superficie |
| Diminuzione della Pressione | Aumenta il tasso di evaporazione e la purezza | Rimuove la resistenza atmosferica, abbassa il punto di ebollizione |
Pronto a Ottimizzare il Tuo Processo di Evaporazione?
Comprendere l'interazione tra temperatura e pressione è fondamentale per ottenere risultati precisi nel tuo laboratorio. Sia che tu debba massimizzare la purezza, proteggere materiali sensibili al calore o aumentare i tassi di deposizione, avere l'attrezzatura giusta è fondamentale.
KINTEK è specializzata in apparecchiature da laboratorio di alta qualità, inclusi sistemi a vuoto e soluzioni termiche, progettate per darti un controllo preciso sui tuoi processi. I nostri esperti possono aiutarti a selezionare la configurazione ideale per la tua applicazione specifica, garantendo efficienza, affidabilità e risultati superiori.
Contattaci oggi stesso per discutere le tue esigenze e scoprire come KINTEK può migliorare le capacità del tuo laboratorio!
Guida Visiva
Prodotti correlati
- Pressa termica idraulica elettrica riscaldata a vuoto per laboratorio
- Pressa Idraulica Riscaldata con Piastre Riscaldate per Pressa a Caldo da Laboratorio per Scatola Sottovuoto
- Pressa a Caldo a Doppia Piastra per Laboratorio
- Pressa Idraulica Riscaldata con Piastre Riscaldate per Stampa a Caldo da Laboratorio per Scatola Sottovuoto
- Macchina per forni a pressa a caldo sottovuoto Pressa sottovuoto riscaldata
Domande frequenti
- In che modo la temperatura influisce sulla pressione del vuoto? Padroneggiare la chiave per il controllo del sistema
- Perché una pressa idraulica da laboratorio riscaldata è necessaria per i laminati compositi? Ottenere un'integrità strutturale priva di vuoti
- Qual è la funzione di una pressa termica idraulica? Perfezionamento delle membrane polimeriche per batterie allo stato solido
- Come influenzano i forni di precisione automatizzati l'evoluzione strutturale dello Zr1Nb? Idrogenazione e poligonizzazione master
- Qual è lo scopo di una base riscaldata con aspirazione sottovuoto? Migliorare la precisione del rivestimento MEA e le prestazioni del catalizzatore



















