In un contesto di laboratorio, la rimozione di un solvente per evaporazione comporta l'applicazione di energia, tipicamente sotto forma di calore, e/o la riduzione della pressione ambiente. Ciò fornisce alle molecole di solvente energia sufficiente per sfuggire nella fase gassosa, lasciando dietro di sé i componenti meno volatili della miscela, come il prodotto desiderato. Questo processo viene gestito attivamente utilizzando attrezzature specifiche per controllare la velocità e la temperatura.
La sfida principale della rimozione del solvente non è solo l'evaporazione, ma l'evaporazione controllata. Il tuo obiettivo è rimuovere il solvente il più rapidamente possibile senza degradare o perdere il campione che stai cercando di isolare. Il metodo migliore dipende sempre dalle proprietà del solvente e dalla sensibilità del campione.

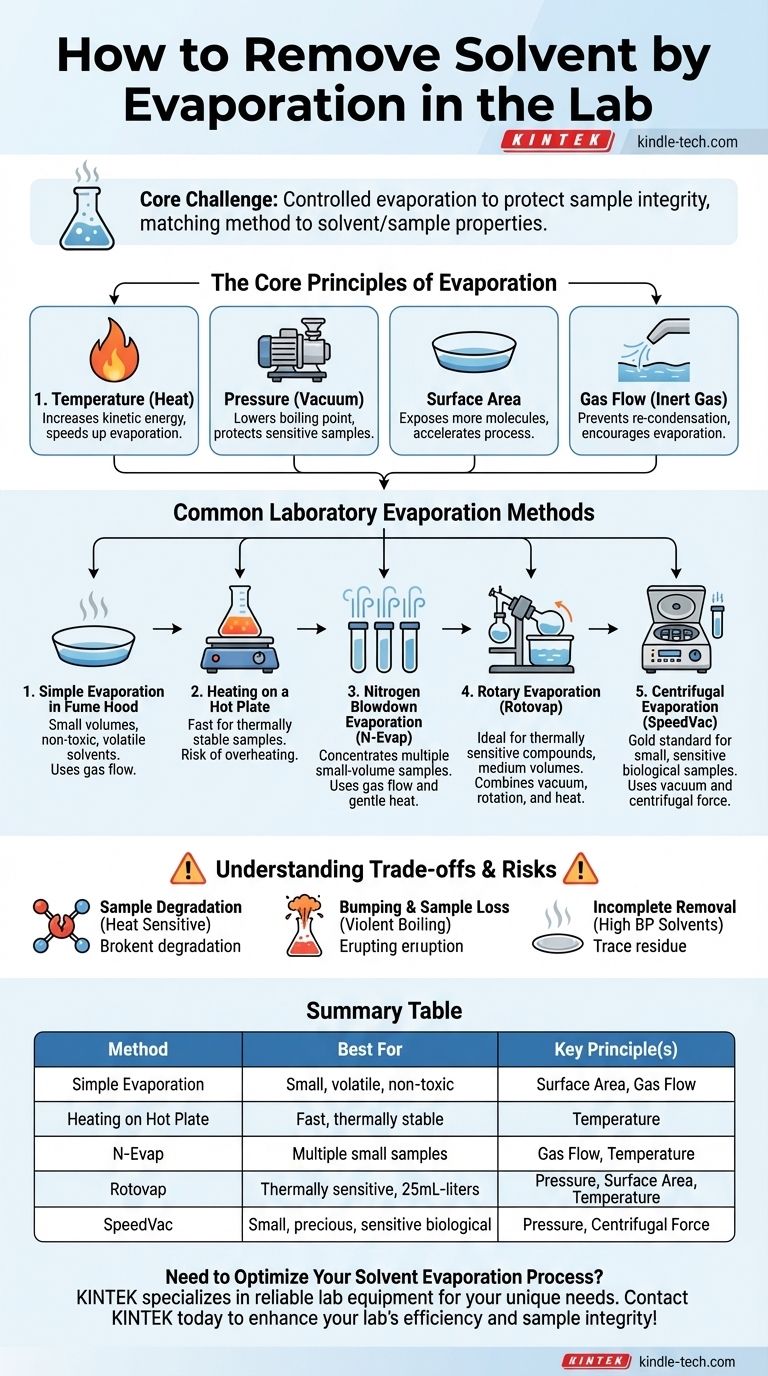
I Principi Fondamentali dell'Evaporazione
Per scegliere il metodo giusto, devi prima comprendere i quattro fattori che puoi manipolare per controllare la velocità di evaporazione. Questi principi sono le fondamenta di ogni tecnica.
Il Ruolo della Temperatura
L'aumento della temperatura di un solvente aumenta direttamente l'energia cinetica delle sue molecole. Ciò rende più facile per esse superare le forze che le trattengono nella fase liquida e sfuggire come gas. Più calore significa evaporazione più rapida.
Il Ruolo della Pressione
Ridurre la pressione sopra un liquido abbassa il suo punto di ebollizione. Questo è il principio più importante per la manipolazione di campioni sensibili. Ponendo un campione sotto vuoto, è possibile far bollire ed evaporare il solvente a una temperatura molto più bassa e sicura, proteggendo il composto dalla degradazione termica.
Il Ruolo della Superficie
L'evaporazione avviene solo sulla superficie del liquido. Aumentando la superficie, si espongono più molecole di solvente alla fase gassosa, accelerando drasticamente il processo. Questo è il motivo per cui una pozzanghera evapora più velocemente della stessa quantità d'acqua in una tazza profonda.
Il Ruolo del Flusso di Gas
Quando un solvente evapora, crea uno strato di vapore appena sopra la superficie del liquido, che può portare alla ricondensazione. Soffiando un flusso costante di un gas inerte (come l'azoto) sulla superficie, si allontana costantemente questo vapore, incoraggiando una maggiore evaporazione del liquido per ripristinare l'equilibrio.
Metodi Comuni di Evaporazione in Laboratorio
Questi principi vengono applicati utilizzando diverse apparecchiature di laboratorio standard, ciascuna adatta a diverse scale e tipi di campioni.
Semplice Evaporazione Sotto Cappa
Questo è il metodo più basilare. Il campione viene posto in un contenitore largo e poco profondo (come una capsula di evaporazione o un vetrino da orologio) all'interno di una cappa aspirante. Il flusso d'aria della cappa fornisce un leggero flusso di gas per allontanare i vapori.
Questo metodo è adatto solo per volumi molto piccoli di solventi non tossici, altamente volatili e per campioni non sensibili all'aria o all'esposizione prolungata.
Riscaldamento su Piastra Calda
Un modo semplice per accelerare l'evaporazione è riscaldare delicatamente il campione su una piastra calda sotto cappa. Ciò applica direttamente il principio dell'aumento della temperatura.
Sebbene rapido, questo metodo offre uno scarso controllo della temperatura e crea un alto rischio di surriscaldamento o "urto" (ebollizione violenta), che può portare alla perdita e alla degradazione del campione.
Evaporazione a Soffiaggio di Azoto
Conosciuta anche come N-Evap, questa tecnica utilizza un collettore per dirigere più flussi sottili di gas azoto sulla superficie dei campioni in fiale o in una micropiastra. Spesso include un delicato riscaldamento da un blocco o da un bagno d'acqua sottostante.
Questo è altamente efficace per concentrare contemporaneamente più campioni di piccolo volume ed è comune nella preparazione dei campioni per la chimica analitica.
Evaporazione Rotante ("Rotovap")
L'evaporatore rotante è il cavallo di battaglia del laboratorio di chimica sintetica. Combina tutti i principi per una rimozione efficiente e delicata del solvente.
- Pressione Ridotta: Una pompa a vuoto abbassa il punto di ebollizione.
- Superficie Aumentata: Il pallone viene ruotato continuamente, rivestendo le pareti interne con un sottile film del campione.
- Riscaldamento Delicato: Il pallone rotante si trova in un bagno d'acqua per un riscaldamento stabile e controllato.
Questo metodo è ideale per composti termosensibili e per rimuovere il solvente da volumi che vanno tipicamente da 25 mL a diversi litri.
Evaporazione Centrifuga ("SpeedVac")
Un evaporatore centrifugo (spesso chiamato SpeedVac) pone i campioni sotto un vuoto profondo mentre li centrifuga. La forza centrifuga previene gli urti e viene applicato un delicato calore tramite radiazione infrarossa.
Questo è lo standard aureo per concentrare in sicurezza molti campioni piccoli, preziosi o sensibili, come DNA, RNA o peptidi, senza alcun rischio di contaminazione incrociata o perdita.
Comprendere i Compromessi e i Rischi
La scelta di un metodo richiede un equilibrio tra velocità e potenziali problemi. Essere consapevoli di questi compromessi è fondamentale per il successo.
Degradazione del Campione
Il rischio principale è la degradazione termica. Molti composti organici e quasi tutte le molecole biologiche possono essere distrutte da un calore eccessivo. Questo è il motivo per cui i metodi che utilizzano la pressione ridotta, come l'evaporazione rotante, sono così essenziali.
Urto e Perdita del Campione
Quando un liquido viene riscaldato sotto vuoto senza agitazione, può surriscaldarsi e poi bollire violentemente in una singola, grande eruzione. Questo fenomeno, chiamato urto, può causare la perdita di una parte significativa del campione nel sistema del vuoto. La rotazione (in un rotovap) o la forza centrifuga (in uno SpeedVac) vengono utilizzate specificamente per prevenire questo.
Rimozione Incompleta del Solvente
I solventi con alto punto di ebollizione come DMSO o DMF possono essere difficili da rimuovere completamente. Anche sotto un forte vuoto, tracce possono rimanere, contaminando il prodotto finale. Questo può talvolta essere risolto aggiungendo un solvente più volatile (come il toluene) e ri-evaporando, un processo noto come essiccazione azeotropica.
Fare la Scelta Giusta per il Tuo Campione
La tua decisione dovrebbe essere guidata dalle caratteristiche del tuo campione e dal tuo obiettivo finale.
- Se il tuo campione è termicamente stabile e il solvente è volatile: Un semplice riscaldamento sotto cappa o un soffiaggio di azoto possono essere sufficienti e veloci.
- Se il tuo campione è termosensibile o in un volume superiore a 20 mL: Un evaporatore rotante è la scelta standard e più affidabile.
- Se hai molti campioni biologici piccoli, altamente sensibili: Un evaporatore centrifugo offre il massimo livello di protezione ed efficienza.
- Se il tuo obiettivo è isolare un prodotto con la massima purezza: Scegli sempre un metodo con vuoto per utilizzare la temperatura più bassa possibile, minimizzando la formazione di sottoprodotti termici.
Abbinando la tecnica alle esigenze del tuo campione, garantisci un'efficiente rimozione del solvente massimizzando l'integrità e la resa del tuo prodotto finale.
Tabella Riepilogativa:
| Metodo | Ideale Per | Principio/i Chiave |
|---|---|---|
| Evaporazione Semplice | Piccoli volumi di solventi non tossici, volatili | Superficie, Flusso di Gas |
| Riscaldamento su Piastra Calda | Rapida evaporazione di campioni termicamente stabili | Temperatura |
| Soffiaggio di Azoto (N-Evap) | Concentrazione di più campioni di piccolo volume | Flusso di Gas, Temperatura |
| Evaporazione Rotante (Rotovap) | Composti termosensibili; volumi da 25mL a litri | Pressione, Superficie, Temperatura |
| Evaporazione Centrifuga (SpeedVac) | Campioni biologici piccoli, preziosi o sensibili | Pressione, Forza Centrifuga |
Hai Bisogno di Ottimizzare il Tuo Processo di Evaporazione del Solvente?
Scegliere l'attrezzatura giusta è fondamentale per proteggere i tuoi campioni sensibili e massimizzare la resa. KINTEK è specializzata nella fornitura di attrezzature e materiali di consumo affidabili su misura per le esigenze uniche del tuo laboratorio.
Sia che tu abbia bisogno di un delicato evaporatore rotante per i tuoi flussi di lavoro di chimica sintetica o di un evaporatore centrifugo ad alta produttività per preziosi campioni biologici, abbiamo la soluzione.
Lascia che i nostri esperti ti aiutino a migliorare l'efficienza del tuo laboratorio e l'integrità dei campioni.
Contatta KINTEK oggi per trovare il sistema di evaporazione perfetto per la tua applicazione!
Guida Visiva
Prodotti correlati
- Liofilizzatore da banco per uso di laboratorio
- Liofilizzatore da Laboratorio da Banco
- Sterilizzatore da Laboratorio Autoclave Sterilizzatore a Sollevamento Sottovuoto Pulsato
- Autoclave da Laboratorio Sterilizzatore Verticale a Vapore Sotto Pressione per Display a Cristalli Liquidi Tipo Automatico
- Vagli da Laboratorio e Setacciatrici
Domande frequenti
- Quali sono i diversi metodi di liofilizzazione? Scegliere il percorso di liofilizzazione giusto
- Quali sono i pericoli degli evaporatori? Gestire i rischi chimici, termici e di pressione
- Come funziona un liofilizzatore? Conservare materiali delicati con la sublimazione
- Quale proprietà determina il tasso di evaporazione? Controlla calore, pressione e superficie per risultati ottimali.
- Perché un liofilizzatore è preferito per le polveri di ossido di grafene ridotto (Hh-RGO)? Preservare la nano-struttura e le prestazioni



















