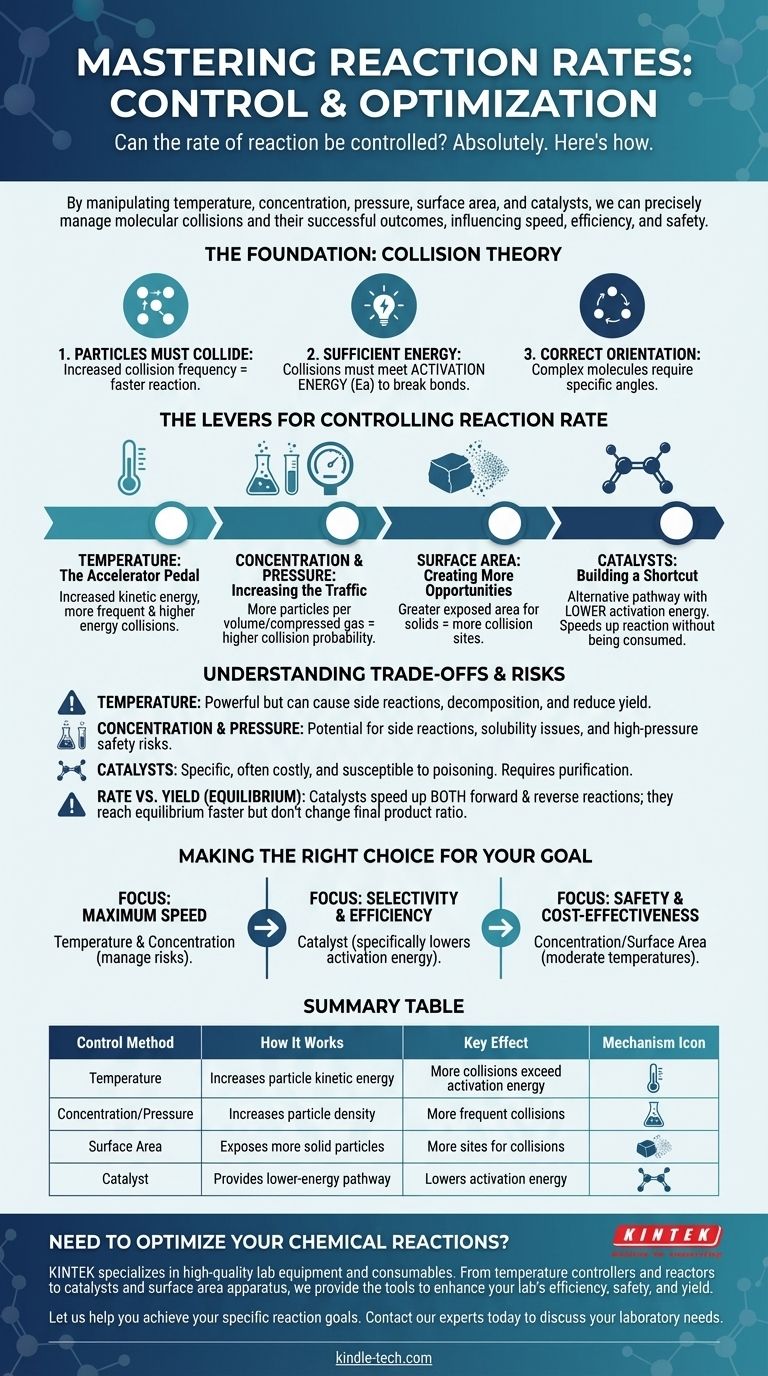
Assolutamente sì. La velocità di una reazione chimica non è una proprietà fissa; può essere controllata con precisione. Manipolando specifici fattori fisici e chimici, possiamo accelerare, rallentare o persino arrestare deliberatamente una reazione. Le leve principali per questo controllo sono la temperatura, la concentrazione dei reagenti, la pressione (per i gas), la superficie (per i solidi) e l'introduzione di catalizzatori.
Controllare la velocità di una reazione significa fondamentalmente gestire la frequenza e l'energia delle collisioni molecolari. Ogni metodo, dal riscaldamento di una sostanza all'aggiunta di un catalizzatore, agisce influenzando la frequenza con cui le particelle si scontrano e se tali collisioni hanno successo.

Le Basi: La Teoria delle Collisioni
Per controllare una reazione, devi prima capire cosa la fa accadere. La velocità di qualsiasi reazione è governata dai principi della teoria delle collisioni, che afferma che tre condizioni devono essere soddisfatte affinché una reazione avvenga.
1. Le Particelle Devono Collidere
Affinché due o più molecole reagiscano, devono prima entrare in contatto fisico. Più frequentemente le particelle collidono, maggiori sono le opportunità che hanno di reagire, il che aumenta la velocità di reazione.
2. Le Collisioni Devono Avere Energia Sufficiente
Semplicemente collidere non è sufficiente. Le particelle che collidono devono possedere una quantità minima di energia cinetica combinata, nota come energia di attivazione (Ea). Questa energia è necessaria per rompere i legami chimici esistenti in modo che se ne possano formare di nuovi.
Le collisioni con energia inferiore all'energia di attivazione non avranno successo; le particelle semplicemente rimbalzeranno l'una sull'altra inalterate.
3. Le Particelle Devono Avere l'Orientamento Corretto
Per molecole complesse, la collisione deve avvenire anche con un angolo o un orientamento specifico. Se le parti reattive delle molecole non si allineano correttamente durante la collisione, non avverrà alcuna reazione, anche se il requisito energetico è soddisfatto.
Le Leve per Controllare la Velocità di Reazione
Comprendere la teoria delle collisioni ci fornisce una chiara tabella di marcia per manipolare la velocità di reazione. Ogni metodo di controllo agisce alterando una o più delle condizioni richieste per una collisione di successo.
Temperatura: Il Pedale dell'Acceleratore
L'aumento della temperatura aumenta l'energia cinetica media delle particelle. Questo ha un potente effetto duplice.
In primo luogo, fa muovere le particelle più velocemente, portando a collisioni più frequenti. In secondo luogo, e più importante, significa che una frazione molto maggiore di quelle collisioni avrà un'energia uguale o superiore all'energia di attivazione, aumentando drasticamente la velocità delle reazioni di successo.
Concentrazione e Pressione: Aumentare il Traffico
L'aumento della concentrazione dei reagenti in una soluzione significa che ci sono più particelle stipate nello stesso volume. Questo aumenta direttamente la probabilità di collisione, aumentando così la velocità di reazione.
Per i gas, l'aumento della pressione ha lo stesso effetto. Forza le molecole di gas ad avvicinarsi, aumentando efficacemente la loro concentrazione e portando a collisioni più frequenti.
Superficie: Creare Più Opportunità
Questo fattore è critico quando un solido reagisce con un liquido o un gas. Rompendo un solido in pezzi più piccoli (ad esempio, da un blocco solido a una polvere), si aumenta drasticamente la sua superficie totale.
Questo espone più particelle del solido all'altro reagente, creando molti più siti dove possono verificarsi collisioni e aumentando la velocità di reazione complessiva.
Catalizzatori: Costruire una Scorciatoia
Un catalizzatore è una sostanza che aumenta la velocità di reazione senza essere consumata nel processo. Funziona fornendo un percorso di reazione alternativo con un'energia di attivazione inferiore.
Un catalizzatore non fa collidere le particelle più spesso o con più energia. Invece, abbassa la "barriera" energetica che una collisione deve superare per avere successo, rendendo molto più facile il procedere di una reazione.
Comprendere i Compromessi e i Rischi
Sebbene queste leve siano efficaci, non sono prive di conseguenze. Scegliere il metodo giusto richiede la comprensione dei loro limiti e dei potenziali svantaggi.
La Forza Bruta della Temperatura
Il calore è uno strumento potente ma indiscriminato. Mentre accelererà la reazione desiderata, accelererà anche eventuali reazioni secondarie. A temperature molto elevate, può persino causare la decomposizione di reagenti o prodotti, riducendo la resa complessiva.
I Pericoli della Concentrazione e della Pressione
Le alte concentrazioni possono talvolta portare a reazioni secondarie indesiderate o problemi di solubilità. Più criticamente, operare a pressioni molto elevate richiede attrezzature specializzate, costose e robuste per gestire i significativi rischi per la sicurezza di un potenziale fallimento del contenimento.
La Specificità e il Costo dei Catalizzatori
I catalizzatori sono spesso altamente specifici e possono essere molto costosi (ad esempio, quelli che utilizzano platino o palladio). Possono anche essere resi inutili dalle impurità, un processo noto come avvelenamento del catalizzatore, che richiede un'attenta purificazione dei reagenti.
Velocità vs. Resa (Equilibrio)
È fondamentale distinguere tra velocità di reazione e resa di reazione. Per le reazioni reversibili, che possono procedere in entrambe le direzioni avanti e indietro, un catalizzatore accelera entrambe le reazioni in egual misura. Ciò significa che si raggiungerà l'equilibrio più velocemente, ma non cambierà il rapporto finale tra prodotti e reagenti.
Fare la Scelta Giusta per il Tuo Obiettivo
La strategia ottimale per controllare una reazione dipende interamente dal tuo obiettivo specifico, che si tratti di velocità, efficienza o sicurezza.
- Se il tuo obiettivo principale è la massima velocità: L'aumento della temperatura e della concentrazione sono i tuoi strumenti più diretti, ma devi gestire attivamente i rischi di reazioni secondarie e pericoli per la sicurezza.
- Se il tuo obiettivo principale è la selettività e l'efficienza: Un catalizzatore è spesso la scelta migliore, in quanto può abbassare specificamente l'energia di attivazione per la reazione desiderata senza promuovere altre.
- Se il tuo obiettivo principale è la sicurezza e l'efficacia in termini di costi: La manipolazione della concentrazione o della superficie a temperature moderate sono spesso i metodi più accessibili e a basso rischio.
Padroneggiare questi fattori ti consente di trasformare le reazioni chimiche da eventi fissi in processi dinamici che possono essere diretti con precisione per raggiungere un risultato specifico.
Tabella Riepilogativa:
| Metodo di Controllo | Come Funziona | Effetto Chiave |
|---|---|---|
| Temperatura | Aumenta l'energia cinetica delle particelle | Più collisioni superano l'energia di attivazione |
| Concentrazione/Pressione | Aumenta la densità delle particelle | Collisioni più frequenti |
| Superficie | Espone più particelle di reagente solido | Più siti per le collisioni |
| Catalizzatore | Fornisce un percorso di reazione a energia inferiore | Abbassa l'energia di attivazione |
Hai bisogno di ottimizzare le tue reazioni chimiche?
Controllare con precisione le velocità di reazione è fondamentale per un lavoro di laboratorio di successo. Che tu debba accelerare una sintesi, migliorare la selettività o garantire un funzionamento sicuro, l'attrezzatura giusta è essenziale.
KINTEK è specializzata nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità per aiutarti a padroneggiare queste variabili. Dai controllori di temperatura di precisione e reattori per la gestione del calore e della pressione a un'ampia gamma di catalizzatori e apparecchi progettati per un'interazione ottimale della superficie, abbiamo gli strumenti per migliorare l'efficienza, la sicurezza e la resa del tuo laboratorio.
Lasciaci aiutarti a raggiungere i tuoi obiettivi specifici di reazione. Contatta i nostri esperti oggi stesso per discutere le tue esigenze di laboratorio e trovare la soluzione perfetta.
Guida Visiva
Prodotti correlati
- Reattori personalizzabili ad alta pressione per applicazioni scientifiche e industriali avanzate
- Reattori da laboratorio personalizzabili ad alta temperatura e alta pressione per diverse applicazioni scientifiche
- Mini reattore autoclave ad alta pressione in SS per uso di laboratorio
- Reattore Autoclave da Laboratorio ad Alta Pressione per Sintesi Idrotermale
- Presse Isostatiche a Caldo WIP Stazione di Lavoro 300Mpa per Applicazioni ad Alta Pressione
Domande frequenti
- Qual è la funzione di un reattore idrotermale a temperatura costante? Attivazione della cenere volante del carbone
- Qual è il contributo di un reattore idrotermale alla costruzione di pori graduati? Modelli di precisione per TAS
- Quali ruoli svolgono gli autoclavi nella sintesi delle zeoliti MFI? Padronanza della crescita cristallina idrotermale
- Qual è lo scopo dell'utilizzo di un reattore idrotermale ad alta temperatura? Migliorare la sintesi del catodo di Iodio@Carbone Attivato
- Qual è lo scopo dell'utilizzo di gas argon ad alta purezza in un reattore ad alta pressione? Garantire dati precisi sui test di corrosione



















